2010/07/07
【概要】
奈良先端科学技術大学院大学(学長:磯貝彰)物質創成科学研究科の超分子集合体科学講座(廣田俊教授)の研究グループと同研究科エネル ギー変換科学講座、兵庫県立大学(学長:清原正義)生命理学研究科(樋口芳樹教授)、理化学研究所SPring-8、同志社女子大学薬学部および西華師範 大学の共同研究チームは、生物の呼吸に不可欠なタンパク質であるシトクロムc (cyt c)について、その分子の立体構造が変化し、いくつもつながった塊(多量体)が鎖状に伸びた構造を形成(ポリマー化)することにより機能を失うメカニズム を初めて明らかにした(図1、2)。若年性認知症、肝硬変、肺気腫、血栓症などを起こすセルピン病では、鎖状に伸びポリマー化したタンパク質が生体組織内 にゴミのように蓄積し、疾病を引き起こすとされており、本研究は、タンパク質構造変異が引き起こす病気の原因解明や予防につながる研究と期待されている。
Cyt cは、細胞内の呼吸の場である小器官のミトコンドリアに含まれる。呼吸に必須のタンパク質で、変性すると鎖状に伸び、ポリマー化することが約50年間前か ら知られていた。しかし、どのような仕組みで変性するか、そのメカニズムは不明のままであった。廣田教授らは、cyt c多量体を作製し、cyt c分子2つ、3つ、4つから成る大きさの揃った純粋な多量体をそれぞれ得て、それらの分子構造と性質を解析する研究を重ねてきた。一方、樋口教授らはそれ らの試料について結晶化に成功し、SPring-8の放射光X線を使って分子構造を解明した。その結果、cyt c が多量体を形成する際、1分子(単量体)をいくつかのパーツ(部分)からなる構造ユニットとしてとらえると、2つの分子が出合うとそれぞれ対応するパーツ を交換して互いに入れ込ませ、パズルのように組み合わされる「ドメインスワッピング機構」が起こっていることを突き止めた。この現象が複数の分子で連続し て起きることにより、cyt c分子が連続的に鎖状に連なってポリマー化するメカニズムを明らかにした。この成果は、7月6日(火)から7月9日(金)までの間にオンライン発行される 米国科学アカデミー紀要に掲載される。【掲載雑誌のプレス解禁日時:平成22年7月7日(水)午前4時(日本時間)】
タンパク質はさまざ まな種類のアミノ酸が長い鎖のようにつながり、その配列(並び順)に従って特定の立体構造を形成して機能を発現する。しかし、タンパク質が構造変性した 時、アミノ酸の長い鎖が元通りにきちんと再フォールディング(折れ畳み)しなかったり、あるいは細胞から排除するための分解が正常に起こらなかった場合、 構造変性して機能を失ったタンパク質が生体組織内にゴミのように蓄積し、それが原因で疾病が引き起こされる。今回明らかとなったcyt cの変性メカニズムは、セルピン病で提唱されているメカニズムと非常に似ており、本研究成果は病気とも関連が深いタンパク質変性メカニズムの解明に役立つ とみられる。
【解説】
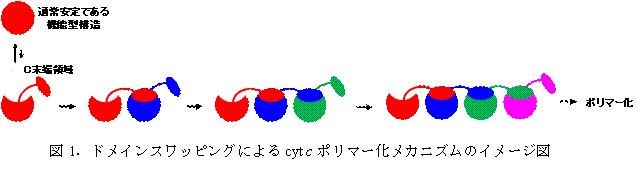
ミトコンドリア内の呼吸に関わる反応で、酸素を水に還元する酵素に電子を伝達する役目のシトクロムc (cyt c)は単量体で機能し、一方で細胞の自殺であるアポトーシスが誘導される際、ミトコンドリアから放出される。Cyt c は変性するとポリマー化するが、そのメカニズムは約50年間不明であった。廣田教授らはウマのcyt cを使い、cyt c分子2つ、3つ、4つと大きさの揃った多量体を作製単離する方法を開発し、各多量体のX線溶液散乱測定、示差走査熱量測定などタンパク質の構造と熱力学 的性質を分子レベルで測定、解析する研究を重ねた。樋口教授らは,それらのうち2量体と3量体のX線結晶構造解析を行った。その結果、cyt c 単量体が構造ユニットとなったドメインスワッピング機構により、cyt c 分子が連続的にポリマー化するメカニズムを明らかにした(図1、2)。
具 体的な実験方法は、まずcyt c単量体、2~4量体、40量体ほどの大きな多量体をそれぞれ精製した。反応の場である活性部位の構造やタンパク質の局所的な立体構造である二次構造は cyt c 2~4量体や40量体ではそれぞれ似ているが、単量体の構造とは若干異なることが、光の吸収スペクトル、CD(円偏光二色性)スペクトルという分子構造を 測定する方法により明らかになった。
さらに、SPring-8の高輝度放射光X線を利用した結晶構造解析により、cyt c 2量体と3量体を構成するアミノ酸のC末端領域がドメインスワッピングしていることが判明し、結晶中のcyt c 2量体および3量体の構造では、電子伝達に重要な鉄-Met(メチオニン、アミノ酸の一種)結合が解離していた。
また、液体に溶けた状態の分子を 測定するX線溶液散乱測定により、水溶液中のcyt c 2~4量体は多量体数の増加とともに鎖状に連なって伸びた構造をしていた。構造変化に伴う熱量変化を分析する手法である示差走査熱量測定により、各多量体 が単量体に解離するとき、モノマーユニット当たり約20 kcal/molのエネルギーが放出された。このエネルギーには、多量体の解離に伴い、Metがヘムに再配位することによる安定化エネルギーが大きく寄与 すると推測された。
以上より、cyt c 2~4量体と40量体付近の多量体のヘム配位構造と二次構造はそれぞれ類似しており、酸化型ウマcyt cはC末端領域が連続的にドメインスワッピングし、タンパク質が鎖状に連なってポリマー化すると推測された。