2019/09/17
細胞表面で波打つ繊毛の微小管の超微細な立体構造の観察に
世界で初めて成功、その内側からの補強機構を解明
~不妊など繊毛病の病態解明にも期待~
【成果の要点】
- 細胞の運動を駆動する繊毛の微小管の立体構造を、クライオ電子顕微鏡を用いて高分解能で決定
- 微小管内のタンパク質が微小管を安定化する機構を初めて解明
- 繊毛の安定化機構の解明は、繊毛病などの遺伝病の病態の理解にも有用
【概要】
ヒトの精子が鞭毛を波打たせて移動するように、真核生物は細胞表面の駆動装置である繊毛・鞭毛により運動しています。ヒトの場合、繊毛・鞭毛の異常は、不妊など繊毛病を引き起こすことも知られています。このように重要な駆動装置である繊毛・鞭毛は一秒間に数十回にも及ぶ波打ち運動をしており、その負荷に耐えるため、繊毛・鞭毛内の軸となる微小管は非常に安定で丈夫な構造をしていますが、その安定化の機構の詳細は分かっていませんでした。
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科 バイオサイエンス領域の市川宗厳助教らの研究グループは、カナダのマギル大学のメンバーらと協力し、超微小な物質の立体構造を得ることができるクライオ電子顕微鏡法を用いて、繊毛の微小管の立体構造をこれまでにない高い分解能(4.3 Å)で得ることに世界で初めて成功しました。これによって、繊毛の微小管内には多数のタンパク質構造が網目状に結合していて、内部から微小管構造を裏打ちすることで補強していることが見出されました。また、微小管の構成要素であるチューブリン(タンパク質)による格子構造は、微小管内タンパク質によって、安定な伸長型の構造に固定されることも明らかとなりました。さらに、京都大学のメンバーと協力することで、微小管内部へのタンパク質の結合がその微小管構造を安定化することを、分子の動きをコンピューター上で再現する「分子動力学シミュレーション」という手法でも示すことが出来ました。
本研究は、細胞の運動駆動を担う繊毛・鞭毛の微小管の安定化機構という生命に根源的な機構を解明し生命科学の発展に寄与するものであるとともに、繊毛病の病態がどのように引き起こされるかを理解する上でも重要な基盤となることが期待されます。
この成果は、米国東部時間の令和元年 9 月 16 日(月)付で Proceedings of the National Academy of Sciences of the United States of America誌(National Academy of Sciences)のオンライン版に掲載されました。
【論文情報】
DOI: 10.1073/pnas.1911119116
naister(NAIST Academic Repository):http://hdl.handle.net/10061/13378
英文Title:Tubulin lattice in cilia is in a stressed form regulated by microtubule inner proteins
【背景と目的】
生物にとって、動くことは非常に重要です。単細胞真核生物やヒトの精子は、繊毛・鞭毛*1という運動駆動装置を用いることで、細胞運動を駆動しています(図1A)。繊毛・鞭毛はまた、ヒトの体内でも、気管内の異物を取り除いたり、脳脊髄液の流れを生み出したりします。さらに、胚発生の際の左右軸を決定することも知られています。そのため、繊毛・鞭毛の異常はヒトにおける不妊や腎臓病など多岐に渡る重篤な症状を引き起こすことが知られており、これらの病態は総じて繊毛病と呼ばれます。これらの繊毛病の病態を理解するためには、繊毛・鞭毛の構造を解明することが必要不可欠でした。
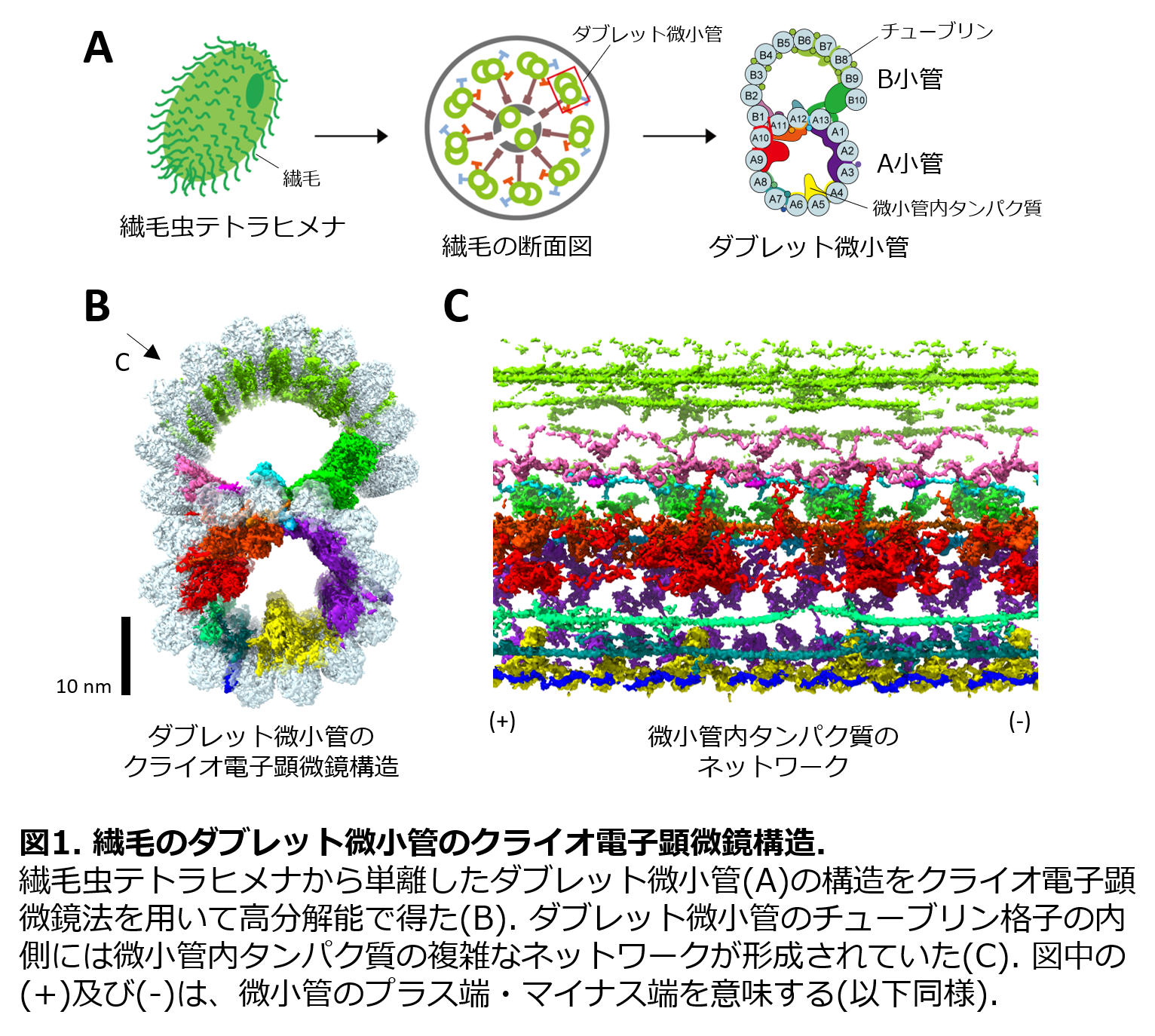
繊毛・鞭毛の内部構造は、微小管*2を中心として構成されており、2本のシングレット微小管(中心対微小管)を9本のダブレット微小管が取り囲んでいるため、「9+2構造」と呼ばれています。このダブレット微小管は、まずチューブリンが集まって繊維状のプロトフィラメント*3になり、それが管状に13本並んだA小管と、10本のB小管の2種類が連なって形成されます(図1A参照)。 一秒間に数十回もの波打ち運動をする繊毛・鞭毛内の過酷な環境に耐えるため、ダブレット微小管は、同じチューブリンを構成要素とする細胞質内のシングレット微小管と比べて非常に安定であることが知られていました。しかしながら、その安定化の詳しいメカニズムは分かっていませんでした。そこで、本研究では、ダブレット微小管をクライオ電子顕微鏡法*4を用いて高分解能*5で立体構造を得ることで、その安定化機構を解明することを目指しました。
【研究の成果】
繊毛・鞭毛の構造は真核生物で良く保存されているため、本研究では繊毛虫テトラヒメナ(Tetrahymena thermophila)を用いて研究を行いました。テトラヒメナ繊毛からさらにダブレット微小管を単離し、クライオ電子顕微鏡を用いて撮影を行いました(図1A)。カナダのマギル大学のThermo Fisher Scientific社製の最新鋭のクライオ電子顕微鏡Titan Kriosを用いることで、構造解析用に質の良い電顕像を大量に集めました。得られた電顕像からダブレット微小管の領域を切り出し、異なる角度から撮られた多数の画像から、元のダブレット微小管の三次元構造を再構成した結果、4.3 Å (1 Åは100億分の1メートル)という分解能でダブレット微小管の立体構造を得ることができました(図1B)。これは、ダブレット微小管の立体構造を、世界で初めて近原子分解能で示した結果です。
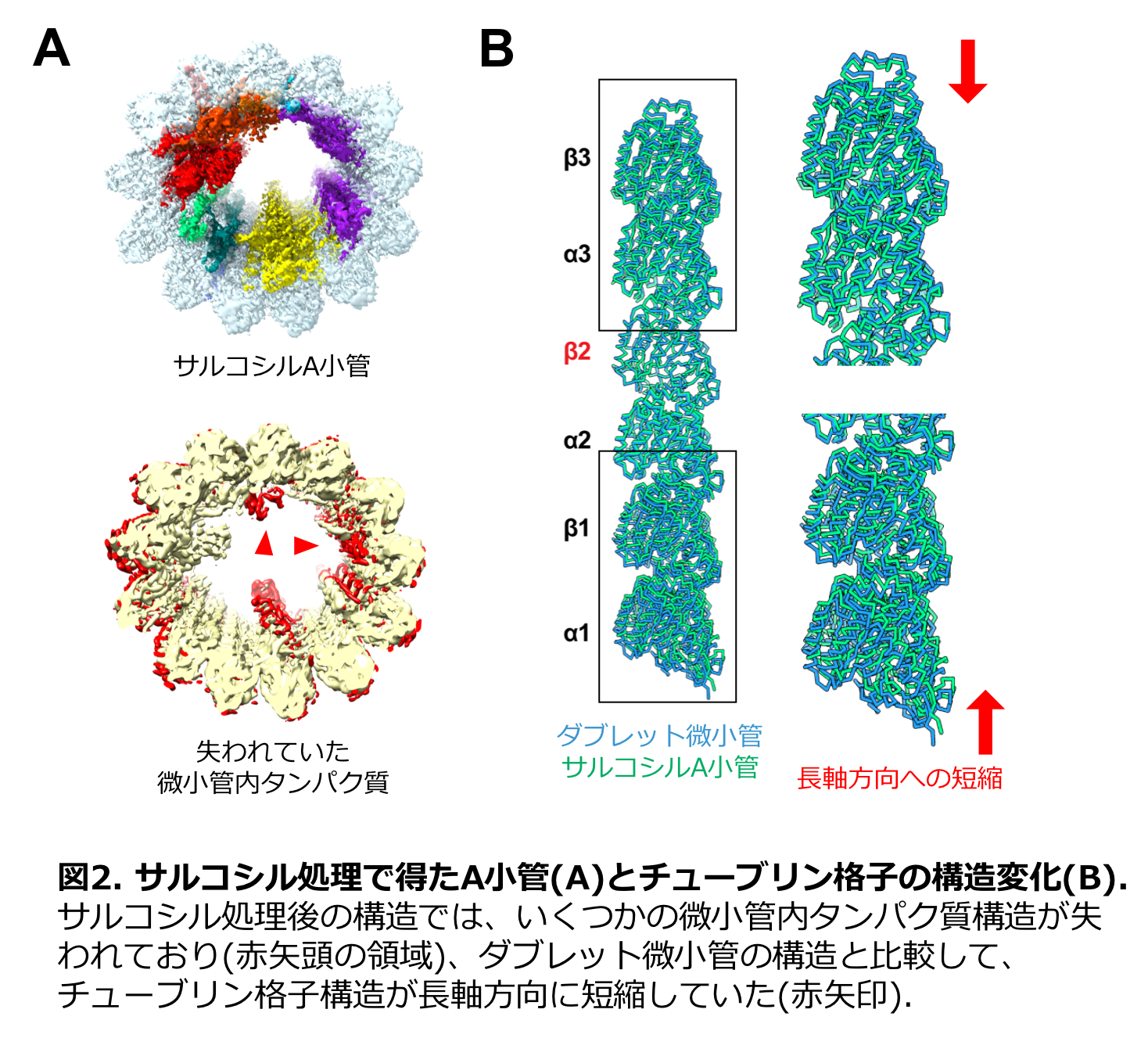
得られた立体構造をみると、ダブレット微小管内には、多数のタンパク質構造が結合している様子が見出されました。また、複数のフィラメント状のタンパク質構造がダブレット微小管内を走っている様子も高分解能で明らかとなりました。これらの微小管内タンパク質構造は、互いに連結しており、ダブレット微小管のチューブリン格子構造を裏打ちしていました(図1C)。特に、A小管内にはB小管と比べてより複雑な微小管内タンパク質のネットワークが存在していました。サルコシルという界面活性剤でダブレット微小管を処理したところ、B小管が先に壊れ始めたことから、この微小管内タンパク質のネットワークがチューブリン格子構造を安定化していると示唆されました。
サルコシル処理で得たA小管についても同様にクライオ電子顕微鏡法によって解析することで、その立体構造を4.9 Å分解能で得ました(図2A)。このA小管のみの構造からは、いくつかの微小管内タンパク質が失われていました。ダブレット微小管と比較すると、チューブリン格子の長さが、長軸方向に2 Å程度短くなっている様子が観察されました(図2B)。この結果は、微小管内タンパク質の結合が、微小管のチューブリンの格子構造の構築に直接影響しているということを示す初めての結果です。
先行研究の結果から、シングレットの微小管のプロトフィラメント内のチューブリンがGTPと結合しているときは伸長した真っすぐな構造をとるが、GTPが加水分解されてGDPになると2 Å程度短くなって屈曲し、プロトフィラメントが剥がれ落ちてチューブリンが脱重合していくことが知られています。一方、我々のダブレット微小管の構造では、結合しているのがGDPであるにも関わらず、チューブリン格子は伸長した安定な構造を取っていました。このため、ダブレット微小管のプロトフィラメントは、内側の微小管内タンパク質によって、安定な伸長型の構造に固定されていると考えられました。
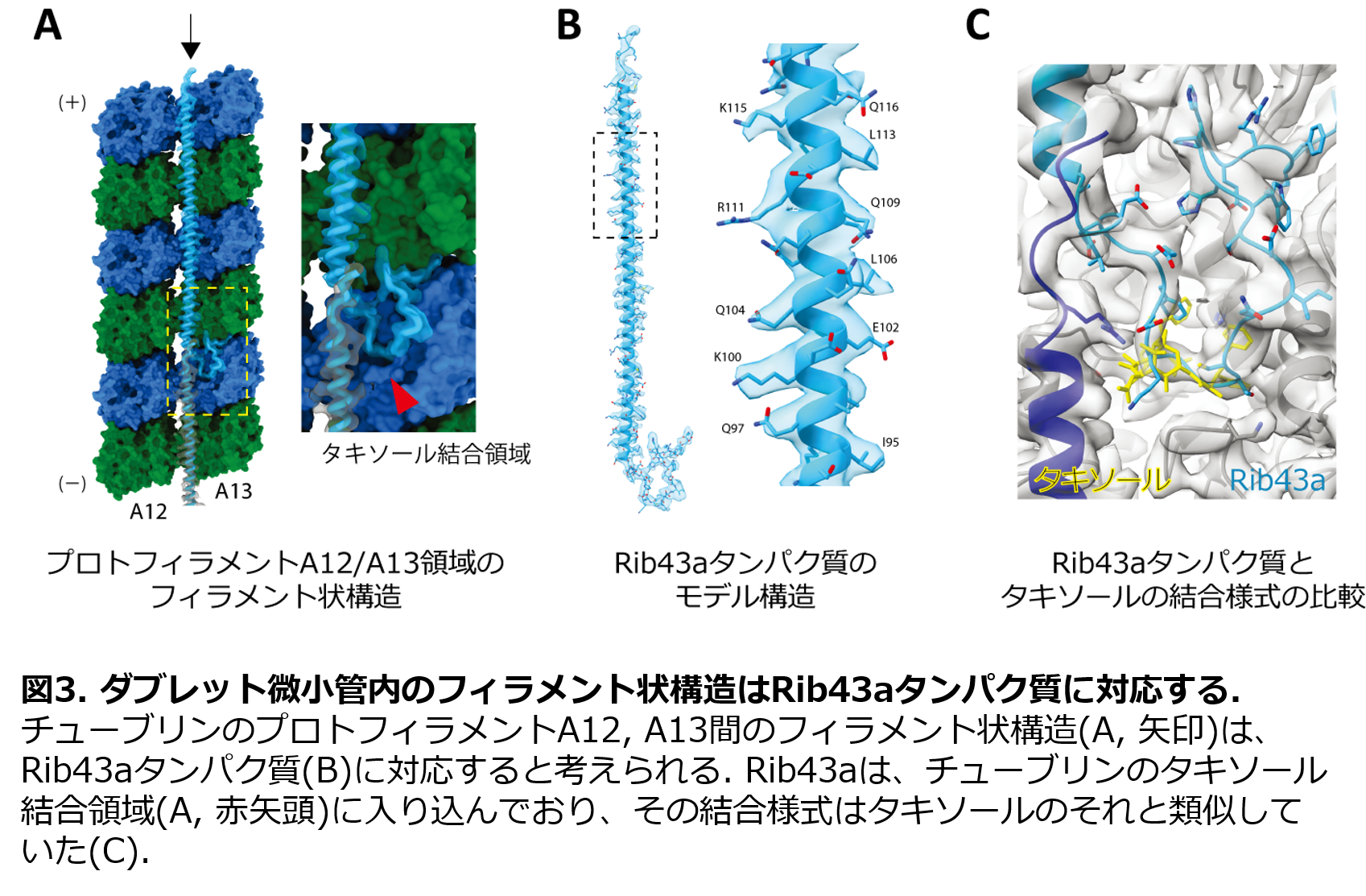
我々のクライオ電子顕微鏡法によって得たダブレット微小管の立体構造では、A小管とB小管の重なっている領域にフィラメント状の構造が走っている様子が観察されました(図3A)。クライオ電子顕微鏡構造をもとに構造モデリングを行うことで、このフィラメント状の構造が、Rib43aと呼ばれるタンパク質に対応していることを明らかにしました(図3B)。Rib43aは、ダブレット微小管に結合していることが知られていましたが、ダブレット微小管内での位置はこれまで特定されていませんでした。さらに、このRib43aは、チューブリンのタキソール結合領域に入り込んでいる様子が観察されました。タキソールは、微小管を安定化させることが知られている抗がん剤としても用いられる低分子化合物です。Rib43aの結合様式は、タキソールのそれと非常に類似しているものでした(図3C)。そのため、Rib43aは、タキソールと同様の機構でプロトフィラメントを安定化していると考えられました。タキソール結合領域に低分子化合物ではなく、タンパク質が結合する様子は、本研究で初めて見出されたものです。そこで、このRib43aがチューブリン格子構造に与える影響を、分子動力学シミュレーション*6を用いて調べたところ、Rib43aがある場合では、ない場合に比べて、チューブリン格子構造がエネルギー的に安定になっていることが分かり、やはり微小管内へのタンパク質の結合が微小管構造を安定化していることが示されました。
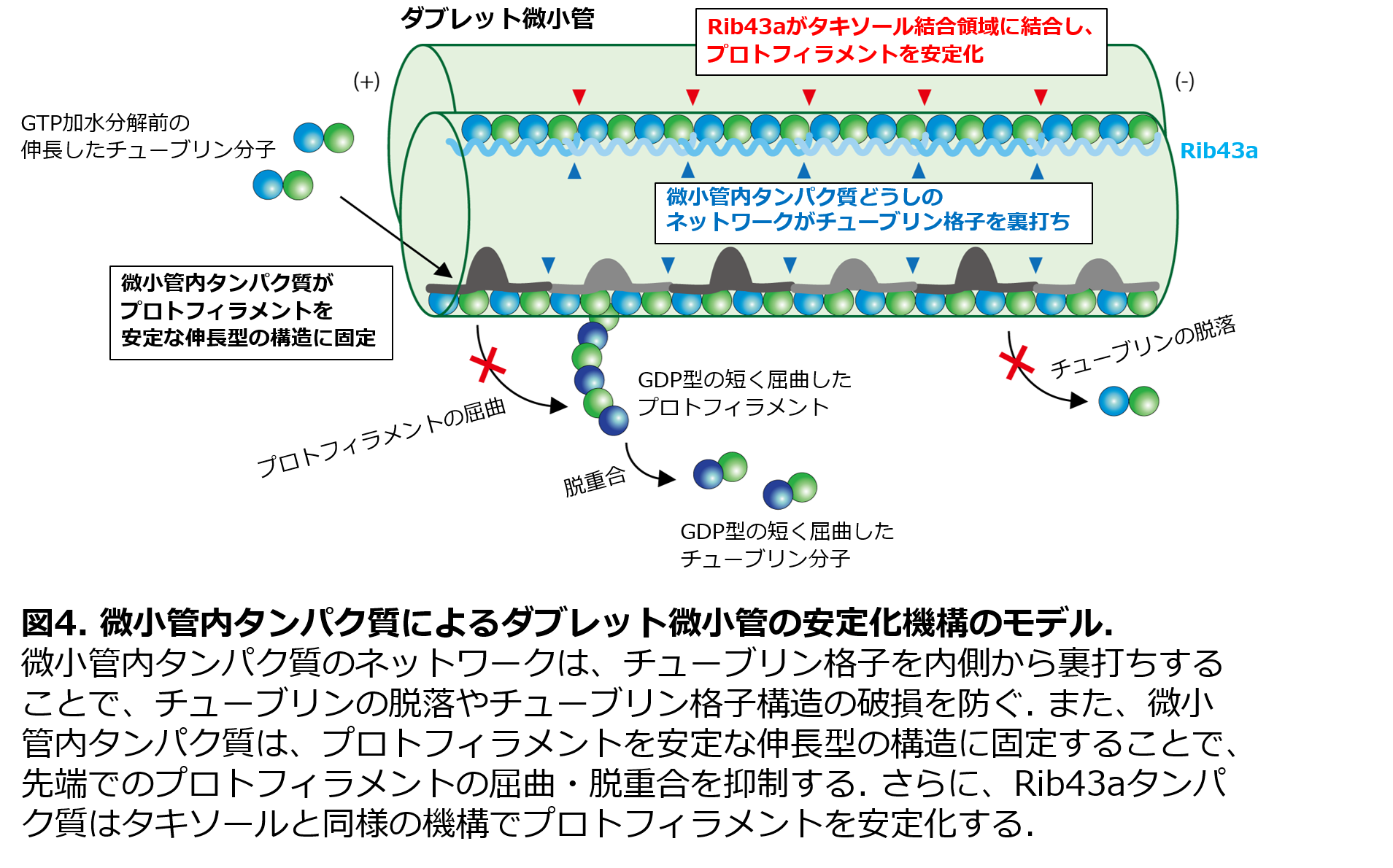
以上の結果を統合し、微小管内タンパク質の結合が、繊毛・鞭毛のダブレット微小管を安定化する機構についての詳細なモデルを提唱しました(図4)。まず、微小管内タンパク質のネットワークは、チューブリン格子構造内を内側から繋ぎとめることで、チューブリン格子構造の破損や、チューブリンの脱落を防いでいると考えられます。また、微小管内タンパク質は、内側からチューブリン格子構造を安定な伸長型の構造に固定しています。これによって、先端においてプロトフィラメントが屈曲して剥がれ落ち、チューブリンが脱重合してしまうことも阻止していると考えられます。さらに、Rib43aは、タキソールと同様の機構でA小管とB小管の間の領域のプロトフィラメントを安定化していると考えられます。
【今後の展開】
本研究によって、繊毛・鞭毛のダブレット微小管の構造を原子レベルに近い分解能で明らかとすることができ、その内部に複雑に結合した微小管内タンパク質の詳細な構造を明らかにすることができました。さらに、A小管とB小管の間のフィラメント状構造がRib43aに対応することを構造モデリングによって示しました。ダブレット微小管内には、この他にも多数のタンパク質構造が存在しているので、今後、他のタンパク質についても構造モデリングや、X線結晶構造解析を行うことでダブレット微小管全体の完全な構造モデルを構築することを目指したいと考えています。ダブレット微小管が内部に結合するタンパク質によって安定化されているという本研究の結果は、これらのタンパク質の生体内での重要性を意味します。これらの微小管内タンパク質の異常が、ダブレット微小管の不安定化を招き、繊毛病の病態を引き起こしていると考えられます。ダブレット微小管内のタンパク質に注目することで新たな繊毛病の原因タンパク質の特定や、診断に繋がる可能性も期待されます。
本研究成果は、日本学術振興会 海外特別研究員制度、日本学術振興会 若手研究者海外挑戦プログラムなどの支援を受けました。
【用語解説】
*1 繊毛・鞭毛
ヒトを始めとする真核生物の細胞から突出している微細な毛のような構造。波打ち運動をすることで、細胞の運動を駆動したり、細胞外液の流れを作り出す。
*2 微小管
チューブリンというタンパク質が複数集まって構成された極小のチューブ状の構造。細胞や繊毛に構造的安定性を与える細胞骨格として働く。
*3 プロトフィラメント
微小管のチューブリン重合体の長軸方向の列。
*4 クライオ電子顕微鏡法
溶液中の生物試料を液体エタンで急速凍結し、電子顕微鏡によって観察することで、生体内に近い状態での構造を観察することができる手法。さらに、多数の電顕像から切り出した粒子を平均化することで、タンパク質の立体構造を高分解能で得ることが出来る。
*5 分解能
どの程度離れた2つの点を分離して認識できるかという指標。小さい値であればあるほど、より詳細な構造が認識できることを意味する。
*6 分子動力学シミュレーション
コンピューターによる計算を用いて、タンパク質が溶液内でどのように挙動するかを調べる手法。
【本研究内容についてコメント出来る方】
東京大学大学院 総合文化研究科 広域科学専攻 生命環境科学系
豊島 陽子
E-mail :cyytoyo[at]mail.ecc.u-tokyo.ac.jp
TEL :03-5454-6752
【本プレスリリースに関するお問い合わせ先】
奈良先端科学技術大学院大学 先端科学技術研究科 構造生命科学研究室
市川 宗厳
E-mail: michikawa〔at〕bs.naist.jp
TEL : 0743-72-5594