2019/10/18
免疫細胞が異物を取り込む装置形成の仕組みを初めて解明
タンパク質が平面状に集まりカップを形成
~免疫反応の抑制など医療応用に期待~
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科 バイオサイエンス領域の末次志郎教授の研究グループは、九州大学、東京工業大学、大阪大学、理化学研究所などと共同で、マクロファージなどの免疫細胞を含む細胞が、病原体などの異物を細胞内に取り込む際に形成される構造である、「ファゴサイトーシス(食作用)カップ(*1)」の形成の仕組みについて、GAS7というタンパク質が、シート状に集合することでなされることを明らかにしました。
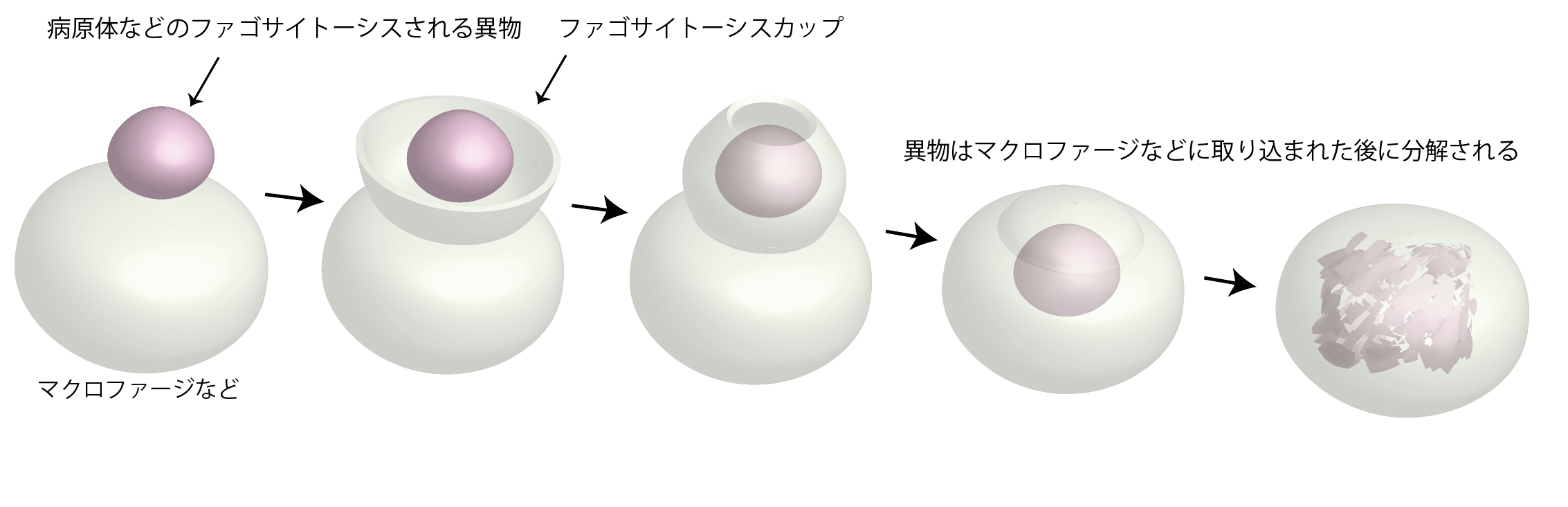
細胞は生体膜によって構成されています。生体膜は、脂質膜(*2)で形成されています。細胞の持つ脂質膜の形態は多様なことが知られていて、その形は、細胞の機能と密接に関わっています。輸送すべき物質と結合した脂質膜の微小領域がくびれて切り離され、小胞となり、脂質膜と一緒に輸送される現象が、細胞内の物質輸送において知られています。この現象は、より大きな病原体などの外敵や異物を取り込んで、消化する免疫応答などにおいても見られます。細菌やウイルスなどの病原体を含む異物が、マクロファージなどの免疫細胞によって取り込まれ、消化される過程は、ファゴサイトーシスと呼ばれ、重要な防御機構となっています。その場合、細胞表面の生体膜、すなわち、細胞膜が突出し、病原体や異物を包み込み、その後に細胞内に取り込みます。この構造は、ファゴサイトーシスカップと呼ばれます。(図1)。取り込まれた異物は、細胞内で消化されます。したがって、ファゴサイトーシスカップの形成機構を理解することは、ファゴサイトーシスの仕組みを理解する上で重要と考えられます。
細胞外からの物質取り込みは、エンドサイトーシス(飲食作用)と呼ばれ、多くの場合、直径が100nm程度の比較的小さな細胞膜の構造形成を通じて行われます。ところが、病原体などは、通常輸送される微少領域よりも格段に大きく、どのように、大きな病原体や異物が取り込まれるための生体膜構造が形成されるか不明でした。これまでに、ファゴサイトーシスカップの形成機構は、突出膜であることから、細胞が移動するときに見られる移動先端のラメリポディア(葉状仮足)などの生体膜構造との類似性が指摘されています。したがって、直径が100nm程度の比較的小さな細胞膜の構造によるエンドサイトーシスに関わるタンパク質とは異なる作動機構を持つタンパク質が関与することが推定されていました。
末次教授らは、Bin-Amphiphysin-Rvs(BAR)ドメイン(*3)と呼ばれるタンパク質ドメインの解析を行ってきました。BARドメインは、脂質膜上で、タンパク質集合を起こすことにより、ブロックのように脂質膜の形状を形成するドメインであることがわかっています。これまでにファゴサイトーシスカップにおいて機能するBARドメインはそれほど知られていませんでした。
そこで、末次教授らは、ヒトにおいては73種あるBARドメインのなかで、ラメリポディアなどに局在することが報告されながら、構造が未解明であるものを探し、GAS7のF-BARドメインに注目しました。このF-BARドメインの立体構造解析を九州大学および理化学研究所と共同で行ったところ、他のタンパク質のF-BARドメインと比較的似通った構造を取っていることを見出しました。ただ、それらのF-BARドメインは、これまでに直径が100nm程度の小さなエンドサイトーシスにおいて機能することが知られていたので、新たにGAS7のF-BARドメインの集合様式を調べると、ファゴサイトーシスで見られる平面のような膜構造に適した集合様式を持っていることを発見しました(図2)。超解像イメージング(*4)により得られたGAS7分子の位置を示す分子座標と数理モデル解析を組み合わせることにより、GAS7の集合が、実際のファゴサイトーシスカップにおいても、結晶解析から得られたモデルに相当することがわかりました。また、細胞生物学的な解析や生化学的な解析を行いGAS7の平面状での集合が、ファゴサイトーシスに必要不可欠であることも示しました。
この研究成果は、Springer Nature の学術誌「Nature Communications」オンライン版に英国時間(夏時間)の2019年10月18日(金)午前10時【プレス解禁日時:日本時間2019年10月18日午後6時】付で掲載されました。
【今後の展開】
ファゴサイトーシスは、免疫などにおける防御反応として実際の反応を実行する過程と捉えることができます。大きな細胞の形態変化を伴うことから、純粋に科学的な興味をかきたてるものでもあります。今回、ファゴサイトーシスカップにおいて、精密な分子集合が機能することが明らかになり、この知見を応用した、例えば過剰な食作用を抑制することで免疫反応を抑制するような、新たな戦略が考えられる可能性があります。
本研究は、内閣府 最先端・次世代研究開発支援プログラム、文部科学省 新学術領域研究「脂質クオリティが解き明かす生命現象」、日本学術振興会(JSPS)科学研究費基盤研究B、C、科学技術振興機構CREST「高精度時空間計測による多元細胞情報統合」などによる支援によって実施しました。
ファゴサイトーシスは、病原体などの異物をファゴサイトーシスカップ形成を通じて取り込み、細胞内で分解する過程です。
GAS7は、ファゴサイトーシスカップにおいて、試験管内と同じ様式で集合します。
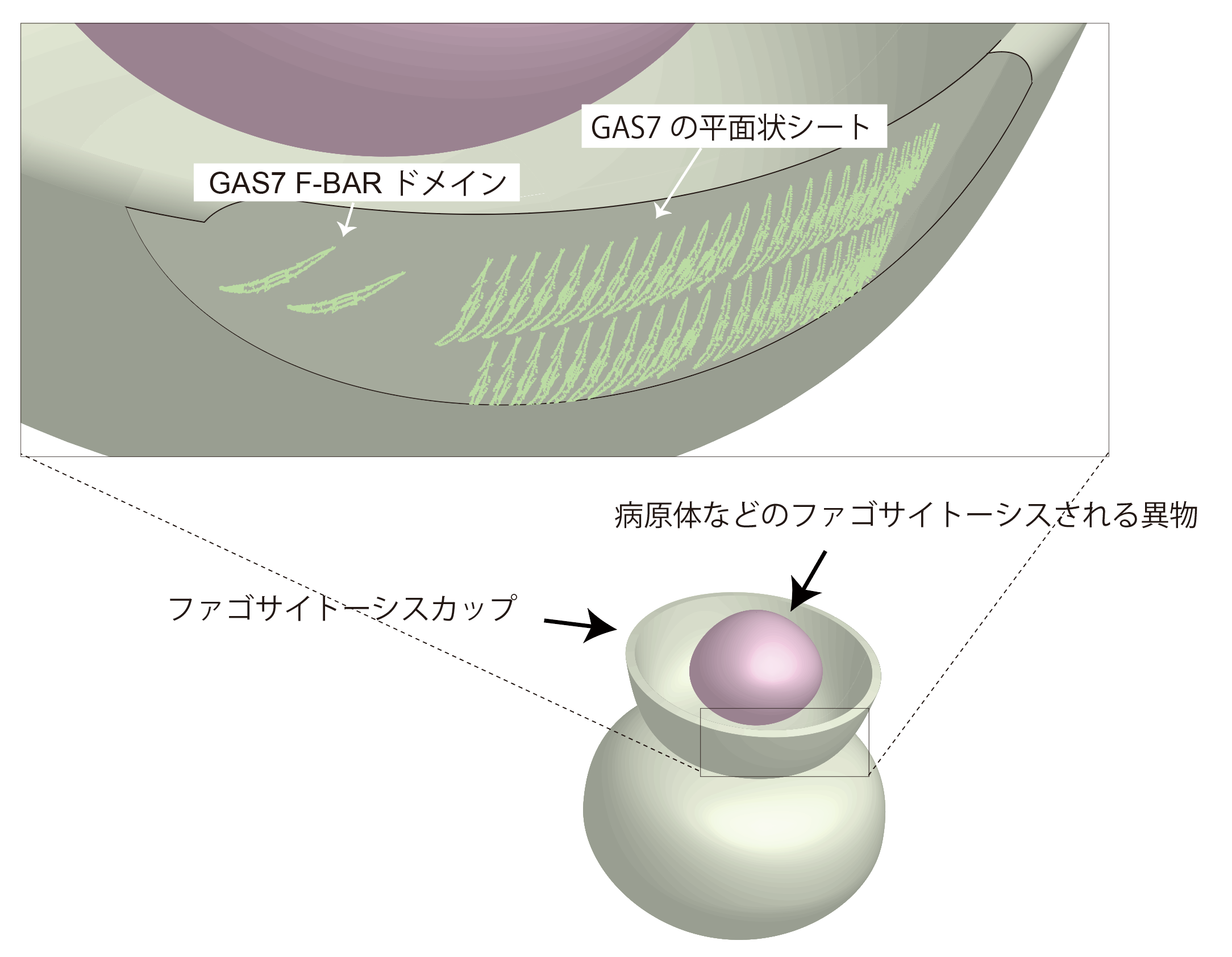
これまで知られていたBARドメインやF-BARドメインは、らせん状に集合し比較的小さな膜直径100nm程度の構造を作る例が多く知られていました。GAS7のF-BARドメインは、直径が10μmに及ぶような比較的平らな生体膜に結合します。これまでに、平らな生体膜におけるF-BARドメインやBARドメインの集合は明らかではありませんでした。試験管内では、GAS7のF-BARドメインは、平面状のシート構造を形成していることがわかりました。同様の構造をファゴサイトーシスカップでも形成していることが、超解像解析により示されました。
【用語解説】
(*1)ファゴサイトーシス
ファゴサイトーシスは、生体にとって異物と認識される、細胞にとっては比較的おおきな直径が数―数十マイクロメートルの大きさの病原微生物やウイルス、あるいは死んだ細胞やその他微粒子を細胞が取り込む過程です。マクロファージや好中球、単球などの主に免疫細胞において活発に行われ、生体防御機構として重要であると考えられています。ファゴサイトーシスは、ファゴサイトーシスカップと呼ばれる構造が、細胞の表面から突出して形成され、ファゴサイトーシスカップが異物を包み込むようにして生じます。ファゴサイトーシスカップの形成機構は、細胞膜が突出する構造体であるラメリポディア(葉状仮足:細胞の移動に関与)との類似性が指摘されていましたが、その詳細な形成機構は明らかではありませんでした。
(*2)脂質膜
生体膜は脂質膜から構成され、脂質膜を構成する脂質は両親媒性脂質です。両親媒性脂質は水になじむ親水性部分と水になじまない疎水性の部分からなります。水溶液中では水になじまない疎水性の部分が水中で向き合い、水になじむ親水性の部分が水溶液に面しています。生体膜を構成する両親媒性脂質として代表的なものに、フォスファチジルセリン、フォスファチジルコリン、フォスファチジルエタノールアミンなどがあります。
(*3)Bin-Amphiphysin-Rvs(BAR)ドメイン
BARドメインはカーブ構造をしており、脂質膜に結合することで、タンパク質の形を鋳型として、小胞を含む脂質膜の形態を形成します。タンパク質が鋳型のように機能することで生体膜の形態を制御するタンパク質として知られているタンパク質です。BARドメインは、BAR、F-BAR、I-BARの3種に大別されます。これまでに知られていたBAR、F-BAR、I-BARドメインは、直径が数百ナノメートル程度の細い管状の生体膜構造においてらせん状に集合することで機能することが知られていましたが、ファゴサイトーシスカップにおいて機能するBARドメインを持つタンパク質とその集合機構については明らかではありませんでした。
(*4)超解像イメージング(超解像顕微鏡)
光学顕微鏡の解像度は、観察に用いる光の波長によって制約されます。ところが、観察された像が1分子のタンパク質に由来することがわかっている場合には、1分子の場所(座標)を、光の波長よりも細かい解像度で決定することができます。1分子の観察を行った後に、観察を行った分子が見えないように消光し、次に別の1分子が観察できるようにする操作を繰り返すことで、多数の分子の座標を決定することができます。出来上がった分子の座標の全体は、光の波長による制約を超えた精度を持っています。本研究では、この分子の座標を用いて、GAS7タンパク質のブロックのような集合様式を数理的に解析しました。
【書誌情報】
"Phagocytosis is mediated by two-dimensional assemblies of the F-BAR protein GAS7"
Nature Communications、 10/18/2019、doi: 10.1038/s41467-019-12738-w.
【本プレスリリースに関するお問い合わせ】
<研究に関する事>
奈良先端科学技術大学院大学 先端科学技術研究科
バイオサイエンス領域 分子医学細胞生物学研究室
教授 末次志郎
TEL:0743-72-5430
E-mail:suetsugu〔at〕bs.naist.jp
九州大学 生体防御医学研究所
分子機能制御学部門 構造生物学分野
准教授 嶋田睦
TEL:092-642-6833
E-mail:ashimada〔at〕bioreg.kyushu-u.ac.jp
<報道に関する事>
奈良先端科学技術大学院大学 企画総務課 広報渉外係
TEL:0743-72-5026 FAX:0743-72-5011
E-mail:s-kikaku@ad.naist.jp
九州大学広報室
TEL:092-802-2130 FAX:092-802-2139
E-mail:koho@jimu.kyushu-u.ac.jp






