2012/11/06
【概要】
生物は環境に適応するため、外部の光に反応し構造を変化することで情報を伝える重要なタンパク質(光センサータンパク質)を持っている が、その動きを世界最高の分解能で可視化することに、奈良先端科学技術大学院大学(学長:磯貝彰)物質創成科学研究科 エネルギー変換科学研究室 の上久保裕生准教授と片岡幹雄教授らが成功した。米国立衛生研究所・国立糖尿病・消化器・腎疾病研究所のフィリップ・アンフィンラド(Philip A. Anfinrud)教授らとの共同研究。光センサータンパク質が光を吸収した直後の100ピコ(1兆分の1)秒から、構造が大きく変化するミリ(1000 分の1)秒に至るまでの間、タンパク質の時々刻々の動きを、空間分解能1.6Å(オングストローム、100億分の1㍍)、時間分解能120ピコ秒という、 世界最高の時空間分解能で可視化することができる。100ピコ秒を1分として考えると、これは分子の20年の長きにわたる活動を観察したことに相当する。 反応に伴う原子レベルでの動きを画像化して手に取るように見えるうえ、未知の構造変化も明らかになった。
上久保准教授と片岡教授は、 イェロープロテインといわれる光受容タンパク質について、均質で大きく、壊れにくい良質な結晶の調製に成功した。アメリカのグループと協力して結晶の構造 が詳細にわかる放射光を用い、連続写真のように構造の変化を追跡する「時間分割結晶構造解析」を行った。その結果、これまでの時間分解能、空間分解能をと もに凌駕することができ、タンパク質の原子レベルでの変化の様子を正確に解析した。原子スケールの変化が物質全体に伝播していく現象は、ピコ秒からミリ秒 の領域で起こる。今回、イェロープロテインが光を吸収した後、どのように情報が構造変化として伝わるのかが手に取るように見えるようになった。また、これ まで知られていなかった初期の構造変化も明らかにした。ピコ秒からミリ秒という広範な時間領域で生じる形の変化を、原子分解能で解析できる本手法は、タン パク質の機能解明のためだけではなく、フォトクロミック分子や有機半導体に代表される光応答性分子の反応過程の可視化など物質科学全般に広く応用されるも のと期待される。
この成果は高く評価され、平成24年11月5日(月)から9日(金)の間にアメリカ科学アカデミー紀要 (Proceedings of National Academy of Science, U.S.A.)の電子版に掲載される予定である。【プレス解禁日時:日本時間平成24年11月6日(火) 午前5時】。
【解説】
研究の背景
生物は環境に適応するために、外界の変化を常にモニターするセンサーを持っています。外界からのシグナルを受容するのが、センサータンパク質であり、センサータンパク質の刺激への応答による変化は、情報伝達の大本としてその分子機構の解明が期待されていました。
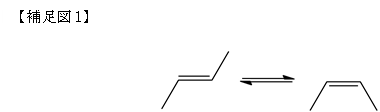
そ の情報伝達の仕組みの中で、生物は多くを光によって獲得しています。光センサータンパク質は、光情報処理の最上流に位置しており、迅速かつ高効率に、光を 吸収し形を変え、その情報を伝えていく性能が要求されます。光センサータンパク質の機能は、①タンパク質中の低分子の有機化合物が光を吸収し形を変える (光異性化反応、補足図1)、②低分子化合物の形が変わることによって周りのタンパク質の形を変える、という2段階の変化によって構成されています。①の 変化はピコ秒(1ピコ秒は1秒の1兆分の1)という非常に早い時間領域、②はミリ秒(1ミリ秒は1秒の1000分の1)という①からずっと後になって生じ る変化です。センサータンパク質の動作メカニズムを理解するためには、①②の反応をつぶさに観察する必要があるのですが、ピコ秒といった短い時間の間に生 じる形の変化を原子が区別できる分解能で観察し、その後、時々刻々変化する様子をミリ秒まで観察することは困難でした。
研究の手法
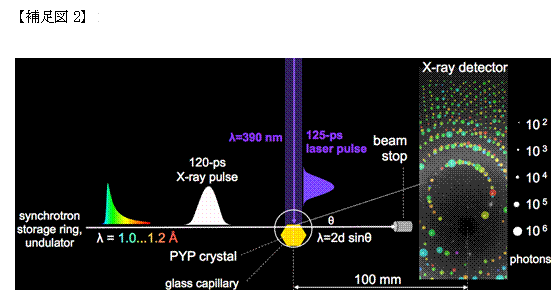
本 研究では、イェロープロテインと呼ばれる光センサータンパク質が光を吸収した直後、ピコ秒領域で生じる現象を観察するために、時分割ラウエ結晶構造解析と いう手法を用いました(補足図2)。この方法は、既に確立していましたが、時間分解能がナノ秒よりも悪く、空間分解能も限られているのが難点でした。今 回、良質の大きな結晶を用いることで、精密な画像が得られる空間分解能を高め、アメリカのAPS(Advanced Photon Source)という新世代放射光施設における専用の装置の改良により撮影時間の間隔である時間分解能を100ピコ秒にまで高めることに成功したのです。
大 強度のパルスX線を何度もタンパク質結晶に照射するとそれだけで試料がダメージを受けてしまいます。この実験では、均質でありながら2mmに及ぶ大きな結 晶(補足図3)を用い、X線を照射する場所を順次移動しながら測定することで、この問題を解決しました。通常、このような測定の仕方をすると、結晶中、X 線があたっている場所の微少な違いによって誤差が大きくなってしまうのですが、我々が調製した良質結晶を用いることで誤差を最小限に抑えることができまし た。
結果
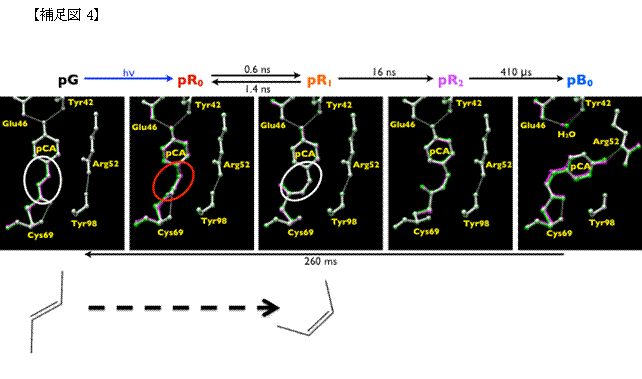
光センサータンパク質では、補足図1に示したような2重結合を持つ分子が光を吸収する役割を担っています。このような分 子は、図のような2つの安定な形(左:トランス体;右:シス体)をとることができます。室温では、この2つの形を行き来させることは困難なのですが、光に よって分子を揺さぶることによって、強制的に形を変えることができるようになります(光異性化反応)。光センサータンパク質では、この反応の効率を極限ま で高め、最初の反応①に利用しています。しかしながら、この反応は非常に速いため、トランス体からシス体に変わっていく様子を観察することができず、その 高効率反応を実現するメカニズムがよくわかりませんでした。本研究によって、補足図4中pR0に示したように、丁度、シス体とトランス体の中間的な構造を とる状態が存在することを初めて明らかにしました。pR0は、タンパク質が光を吸収した200ピコ秒後の様子を示しており、このような中間的な構造がタン パク質によって安定化されていることが、高い異性化反応効率を示す要因の一つになっていると考えることができます。今回の研究では、ミリ秒に至るまでの変 化を観察することによって、最終的に平面型のシス体に至るまで変化していく様子、更に、その変化がタンパク質部分に変化が伝播している様子を可視化するこ とに成功しています。光センサータンパク質は、最終的に、タンパク質全体の構造を変化させることによって、細胞に光の情報を伝播させていくのですが、この 成果によって、光異性化反応によってどのようにしてタンパク質全体構造変化を誘導しているのか明らかになってくると期待されます。(実際には、動画として お見せいたします。)
研究の意義と位置づけ
本研究では、光異性化反応という、基本的な化学反応を可視化することに成功しました。 光異性化反応は、タンパク質だけでなく、様々な光応答性化合物によって利用され、光センサーや光記録ディスクなどで応用されています。本研究は、これまで 未解明だった生物の光情報変換の初期過程を明らかにしただけではなく、高い光応答性を要求する材料開発研究へのヒントを与えることになると考えられます。 本研究で開発した測定手法は、ピコ秒からミリ秒という非常に広い時間領域で生じる現象の観察を可能とし、その結果、タンパク質を構成するごく一部分で生じ る小さな変化が、タンパク質全体に伝わっていく様子を可視化できました。このような、ミクロからマクロへの状態変化の伝播は、物質一般に見られる現象であ り、ここで開発した測定手法は、タンパク質科学のみならず、物質科学全般に適応可能な一般的手法となり得ると期待されます。
【関連リンク】
・論文は以下に掲載されております。
http://dx.doi.org/10.1073/pnas.1210938109
http://library.naist.jp/dspace/handle/10061/8581(NAIST Academic Repository: naistar)
・以下は論文の書誌情報です。
Friedrich Schotte, Hyun Sun Cho, Ville R. I. Kaila, Hironari Kamikubo,
Naranbaatar Dashdorj, Eric R. Henry, Timothy J. Graber, Robert Henning,
Michael Wulff, Gerhard Hummer, Mikio Kataoka, Philip A. Anfinrud,
Watching a signaling protein function in real time via 100-ps
time-resolved Laue crystallography, PNAS : proceedings of the National
Academy of Sciences of the United States of America, November 6, 2012