2013/07/02
【概要】
奈良先端科学技術大学院大学(奈良先端大、学長:小笠原直毅)バイオサイエンス研究科ストレス微生物科学研究室の 高木博史教授らのグループは、活性酸素による酸化ストレスから酵母を防御する新発見の仕組みの中で、重要なカギとなるタンパク質分子「アセチル基転移酵素 Mpr1」の立体構造を明らかにした。また、得られた立体構造の情報をもとに、精製した酵素を用いた試験管内での実験や変異型の酵素を発現する酵母につい ての解析などを行い、Mpr1の反応機構や細胞内での機能を解明した。
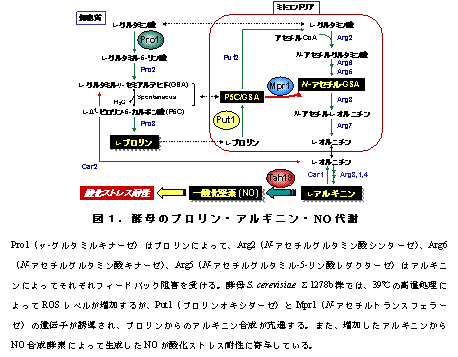
酵母は高等生物のモデル生物として学術上だけでなく、パン類や酒 類、バイオエタノールなど多くの発酵生産に使用され、産業上も有用な微生物である。高木教授らのグループは最近、高温処理など酸化ストレス下の酵母におい て、Mpr1の働きによりプロリンからアルギニンというアミノ酸の合成が亢進し、増加したアルギニンから一酸化窒素が合成されること、また、生成した一酸 化窒素(NO)が酸化ストレスから酵母を防御していることを見出した(図1)。この新たな抗酸化の仕組みにおいて、Mpr1 はプロリン代謝の中間体にアセチル基を転移し(アセチル化)、プロリンとアルギニンの代謝を連結する重要な酵素である。Mpr1の遺伝子は酵母に広く存在 しているが、他の生物を含めこれまで知られているアセチル基転移酵素と類似性が低く、基質に対する特異性も異なることから、新規な酵素と考えられており、 立体構造や反応機構が不明であった。
本研究では、精製したMpr1タンパク質の結晶を調製し、X線結晶構造解析によりMpr1が基質を認 識し、複合体にある状態の立体構造を原子レベルで明らかにした。その結果、得られた構造をもとに、Mpr1の反応機構に深く関わる部位(アミノ酸残基)を いくつか同定し、またそれらのアミノ酸残基がMpr1を介した酵母の酸化ストレス防御機構に関与することが示された。
本研究によって、 Mpr1のユニークな基質認識や活性制御の分子機構を明らかにするとともに、Mpr1が関与する酵母の抗酸化メカニズムへの理解を深めることができる。ま た、より高い活性や安定性を有するMpr1の分子設計が可能となり、発酵プロセスで酵母が受ける酸化ストレスへの耐性が向上し、発酵能が飛躍的に向上した 産業酵母の育種への応用が期待される。さらに、Mpr1の遺伝子は多くの真菌(酵母、カビ)に保存されているため、立体構造をもとにMpr1の活性や機能 を特異的に阻害する化合物を設計することで新たな抗真菌薬の開発につながる可能性がある。
本研究の成果は高く評価され、平成25年7月1 日(月)の週に米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)の電子版に掲載される。
【解説】
[研究背景]
酵母 Saccharomyces cerevisiaeは製パンや醸造、バイオエタノール生産など発酵産業において有用な微生物である。しかし、発酵過程において高温、高浸透圧、冷凍、乾 燥、高濃度エタノールなどの過酷な環境に曝されると、細胞内にミトコンドリア膜の損傷などによって活性酸素(ROS)が生成し、酸化ストレス状態に陥るた め、酵母の生育や発酵力が著しく阻害される。植物でもROSによる光合成や生育の阻害が見られ、ヒトにおいても酸化ストレスと疾病・老化との関連が注目さ れている。したがって、細胞の酸化ストレスに対する生存戦略を理解することは基礎・応用の両面で極めて重要である。
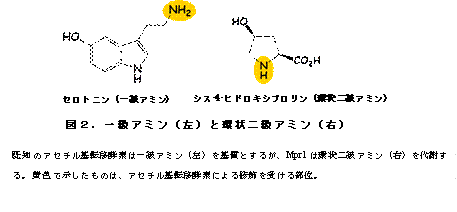
高木教授のグループ は、酵母を用いて細胞の新しいストレス耐性機構を解析しており、これまでに新規なアセチル基転移酵素Mpr1がプロリン代謝を介したストレス耐性機構に関 与することを見出した。一方、Mpr1は既知のアセチル基転移酵素と類似性が低く、基質特異性も異なる。ちなみに、既知酵素は一級アミン(アンモニアを構 成する水素1個を炭化水素基で置換)を基質にするが、Mpr1は環状二級アミン(水素2個を炭化水素基で置換し、アンモニア分子を含めた環状構造を持つ) を代謝する(図2)。以上のことから、学術面(新規酵素の構造・機能)および応用面(酵母のストレス耐性・発酵能向上)の観点で興味深い酵素であるため、 解析を行った。
[研究結果]
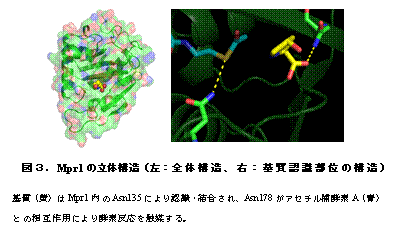
Mpr1は既知の酵素と類似性が低いため、立体構造や反応機構の予測が難しい。そこで、高木教授らは 精製したMpr1タンパク質の結晶を調製し、X線結晶構造解析によりMpr1の立体構造を基質(シス-4-ヒドロキシプロリンを用いた)との複合体として 原子レベルで明らかにした(図3)。その結果、既知のアセチル基転移酵素ファミリーに保存される特殊な構造(-bulge)を形成しないことで、基質で ある環状二級アミンの結合による立体障害を回避していることが示唆された。
また、立体構造から135番目の位置のアスパラギン残基 (Asn135)が基質の認識に、178番目の位置のアスパラギン残基(Asn178)が反応の触媒に重要であると予測できた。実際にこれらのアミノ酸残 基を人為的に別のアミノ酸に置換すると、Asn135の変異体は基質との親和性が、Asn178の変異体は触媒活性がそれぞれ著しく低下したことから、 Asn135が基質の認識・結合に、Asn178が触媒活性にそれぞれ寄与していると結論づけた(図3)。さらに、これらの変異型Mpr1を酵母で発現さ せると、野生型Mpr1の発現酵母に比べて高温処理後のプロリン代謝中間体レベルが増加し、反応が進まなかったことから、Asn135およびAsn178 はMpr1の生理機能においても重要であることが明らかとなった。
[研究意義]
様々な環境に曝される生物の細胞内はROSが発生 することで、酸化ストレス状態に陥りやすい。酵母は有用物質の発酵生産に用いられるが、発酵生産の過程で酸素呼吸に伴ってROSが発生し、機能が制限され る。植物では高温、乾燥、強光などが原因でROSが発生し、光合成能や成長速度に支障をきたす。動物ではミトコンドリアからの電子伝達系のタンパク質(チ トクロームc)の放出に伴ってROSが発生し、細胞死が誘導される。このように、細胞内のROSレベルの制御は生物にとって重要な生存戦略であるため、微 生物や植物の酸化ストレス耐性を強化することやガン細胞特異的に細胞死を誘導することは、食品・環境・医薬などのバイオテクノロジーにおいて有用な技術で ある。
高木グループが見出した抗酸化酵素Mpr1は既知のアセチル基転移酵素と異なる基質特異性を有しているため(図2)、その立体構造 と反応機構を明らかにしたことで、アセチル基転移酵素の基質認識や活性制御のメカニズムを酵素のかたちと関連付けて広く一般的に理解する端緒となり得る。
ま た、抗酸化酵素であるMpr1の立体構造と反応機構を明らかにしたことで、酵素機能の向上した新しいMpr1(高い触媒活性・安定性など)の分子設計が可 能となり、将来的には高度なストレス耐性、優れた発酵力を備えた産業酵母(パン類、酒類、バイオエタノールなど)の育種へ応用できる。
さらに、Mpr1をコードする遺伝子は酵母やカビなど真菌類にのみ保存されているため、立体構造と反応機構をもとに、Mpr1の活性や機能を特異的に阻害する低分子化合物を設計することで、新規な抗真菌剤の開発につながる可能性がある。
今 回、酵母に見出したMpr1が関与する新しい酸化ストレス防御機構(プロリンからのアルギニン合成を介して生成するNOによる抗酸化)(図1)は、酵母機 能を利用した発酵産業への貢献のみならず、病原真菌におけるNOの増殖、感染、病原性への寄与などNOの生理機能の解明にも役立つものとして意義深い。
[用語解説]
・酵母
酵 母のうち基礎研究のモデル株を実験室酵母と称する。実験室酵母では遺伝解析やゲノム解析による基礎的知見が蓄積され、遺伝子操作技術も確立しているが、発 酵力は弱く発酵食品等の生産には不適である。一方、製パン・醸造、バイオエタノール生産などに用いられる菌株を産業酵母と称する。産業酵母は発酵性や生育 速度の優れた株が選択されているが、遺伝特性や倍数性が異なり、実験室酵母の知見や技術が有効活用されていない。
・アセチル基転移酵素
基 質となる化合物(アミン)にアセチル補酵素Aのアセチル基を転移させる酵素。遺伝子発現制御、細胞周期、物質代謝、薬剤解毒など重要な生命現象に深く関与 している。既知のアセチル基転移酵素は一級アミンが基質となると報告されているが、Mpr1は環状二級アミンを基質にするユニークな酵素である(図2)。
・活性酸素(ROS)と酸化ストレス
活 性酸素は安定な酸素分子よりも活性化された状態にあり、反応性に富んでいる。スーパーオキシド、過酸化水素、ヒドロキシラジカルなどの活性酸素は、様々な 原因(放射線、紫外線、酸素呼吸、酸化剤、抗ガン剤、重金属など)により細胞内に生成する。通常の細胞には、活性酸素を消去する抗酸化酵素(スーパーオキ シドディスムターゼ、カタラーゼなど)や抗酸化物質(グルタチオン、チオレドキシンなど)が存在する。しかし、活性酸素がこれらの酵素や物質で十分処理さ れず、重要な生体高分子(DNA、タンパク質、脂質など)に損傷を与え、組織障害や細胞死を引き起こす状態を酸化ストレスと称する。
・一級アミンと環状二級アミン(図2)
一級アミンと環状二級アミンは化学的性質や分子構造が異なる。一級アミンを基質とする既知のアセチル基転移酵素と二級アミンを基質とするMpr1では、基質認識部位を含む立体構造や反応機構そのものが異なっていることが今回明らかとなった。
・X線結晶構造解析
タンパク質などの生体高分子のかたちを解析する方法の一つ。目的のタンパク質の結晶を精製し、X線を照射した際の回折データを処理・計算することで、原子レベルで分子のかたちを見ることができる。
【共同研究者(共著者)】
福井県立大学 生物資源学部
教授 日竎 隆雄、講師 伊藤 貴文
奈良先端科学技術大学院大学 バイオサイエンス研究科
教授 箱嶋 敏雄、助教 平野 良憲
【関連リンク】
・論文は以下に掲載されております。
http://dx.doi.org/10.1073/pnas.1300558110
http://library.naist.jp/dspace/handle/10061/8821(NAIST Academic Repository: naistar)
・以下は論文の書誌情報です。
Ryo Nasuno; Yoshinori Hirano; Takafumi Itoh; Toshio Hakoshima; Takao Hibi; Hiroshi Takagi, Structural and functional analysis of the yeast N-acetyltransferase Mpr1 involved in oxidative stress tolerance via proline metabolism, Proceedings of the National Academy of Sciences of the United States of America, July 1, 2013