2016/10/14
【概要】
奈良先端科学技術大学院大学(学長:小笠原直毅)物質創成科学研究科の超分子集合体科学研究室の廣田俊教授と長尾聡助教らの研究グループは、タンパク質と脂質膜が相互作用する様子を測定できる新しい方法を開発しました。細胞呼吸に不可欠で、プログラムされた細胞死(アポト-シス)にも関係する多機能性タンパク質(シトクロムc、図1)が脂質膜と結合する部位を初めて原子レベルで特定しました(図2、3)。シトクロムcは細胞内小器官であるミトコンドリアの脂質膜に結合して細胞呼吸の一端を担っていますが、一方で脂質膜から離れて細胞質基質へ輸送されるとアポトーシスを促進させるという機能を示すことが知られています。今回の成果は、細胞内でのタンパク質と脂質膜の相互作用のパターンを特定する新しい方法を提供するとともに、正常な細胞呼吸および、酸化ストレスやアポトーシス異常により生じる疾病のメカニズム解明につながる研究と期待されています。
シトクロムcはミトコンドリア脂質内膜に結合し、電子を受け渡しする形で呼吸鎖タンパク質の電子輸送を担うとともに、活性酸素(ROS)の除去やアポトーシスのトリガー(引き金)タンパク質としても機能します。シトクロムcのこれらの機能には脂質との相互作用が深く関わっていることが最近の研究により明らかになっているものの、シトクロムcと脂質膜の結合様式を原子レベルで解析する手法が確立されていないために、シトクロムcのこれらの機能がどのように制御されるかは不明なままでした。
また、廣田教授と長尾助教らは、長い脂質分子と短い脂質分子の組み合わせからなるバイセルという微小なモデル細胞膜を作製し、核磁気共鳴分光法(NMR)という分子構造を調べる方法を用いて解析。その結果、シトクロムcがミトコンドリアの脂質内膜に含まれ、その広い分子表面で複数のリシン残基を介して負に帯電しているカルジオリピンというリン脂質分子と結合することを突き止めました(図2)。さらに、この結合は脂質膜中のカルジオリピン分子の数が増えると強くなることも見出しました。つまり、シトクロムcの複数の正に帯電しているリシン残基とカルジオリピン分子を多数含む脂質膜が相互作用することが、シトクロムcが細胞膜に強く結合するのに必須であることを明らかにしました。
この成果は、10月10日(月)にドイツの「Angewandte Chemie International Edition(アンゲバンテ・ケミー・インターナショナル・エディション)」のオンライン版に掲載されました。
【研究の背景】
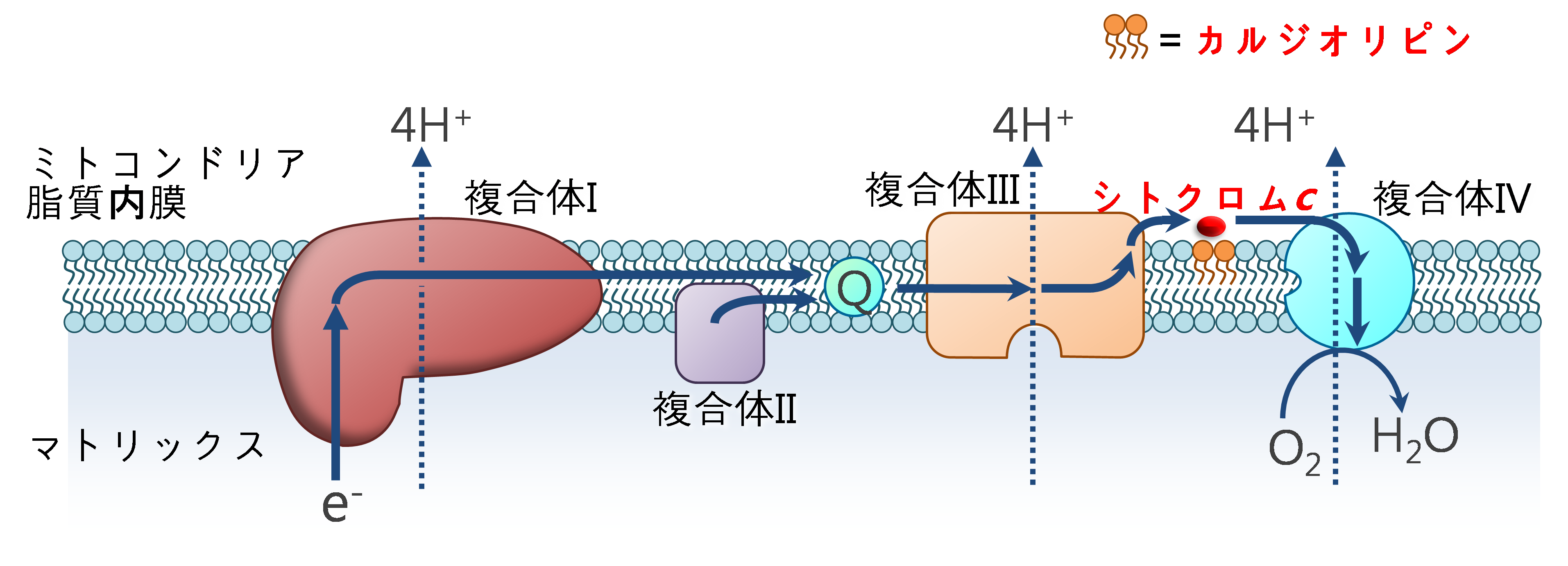
生物の多くは呼吸により空気中から取込んだ酸素を細胞内器官のミトコンドリアで消費し、生命活動のエネルギー源であるアデノシン三リン酸(ATP)を合成しています。シトクロムcは細胞呼吸を担う呼吸鎖タンパク質の一員であり、ミトコンドリアの脂質内膜に含まれるカルジオリピンというリン脂質に結合し、呼吸鎖タンパク質間の電子輸送をしています(図4)。シトクロムcが機能しなくなると、ミトコンドリア内でATP合成が行われなくなるだけでなく、活性酸素(ROS)濃度が著しく上昇します。ROSは、癌やアルツハイマー病、糖尿病などの疾病を引き起こす要因となる酸化ストレスの原因物質の1つとされており、アポトーシスやネクローシスなどの細胞死にも関わっています。
またROSだけでなく、シトクロムcもカルジオリピンを酸化してアポトーシスを促進することが最近の研究により明らかになっています。このようにシトクロムcの脂質膜への結合は細胞の呼吸と死の両方に重要でありますが、シトクロムcと脂質膜の相互作用様式を特定する方法がないため、シトクロムcがどのように脂質膜に結合しているかは明らかになっていませんでした。
核磁気共鳴分光法(NMR)は空間分解能に優れていますが、一般的な脂質モデル膜は大きすぎるため、シトクロムcと脂質膜の相互作用をNMRを用いて解析することは出来ませんでした。そこで、本研究では、NMRを微小な脂質膜であるバイセルと組み合わせることで、タンパク質と脂質膜の相互作用を特定する新しい方法を提供するとともに、シトクロムcが広い分子表面で複数のリシン残基を介して脂質膜中のカルジオリピンと結合し、脂質膜中のカルジオリピン分子の数が多くなるとシトクロムcと脂質膜の結合が強くなることが明らかとなりました。本研究は、シトクロムcが関わる細胞呼吸不全に伴う酸化ストレスおよびアポトーシス異常による疾病を防ぐ方法の開発につながる研究と期待されています。
【解説】
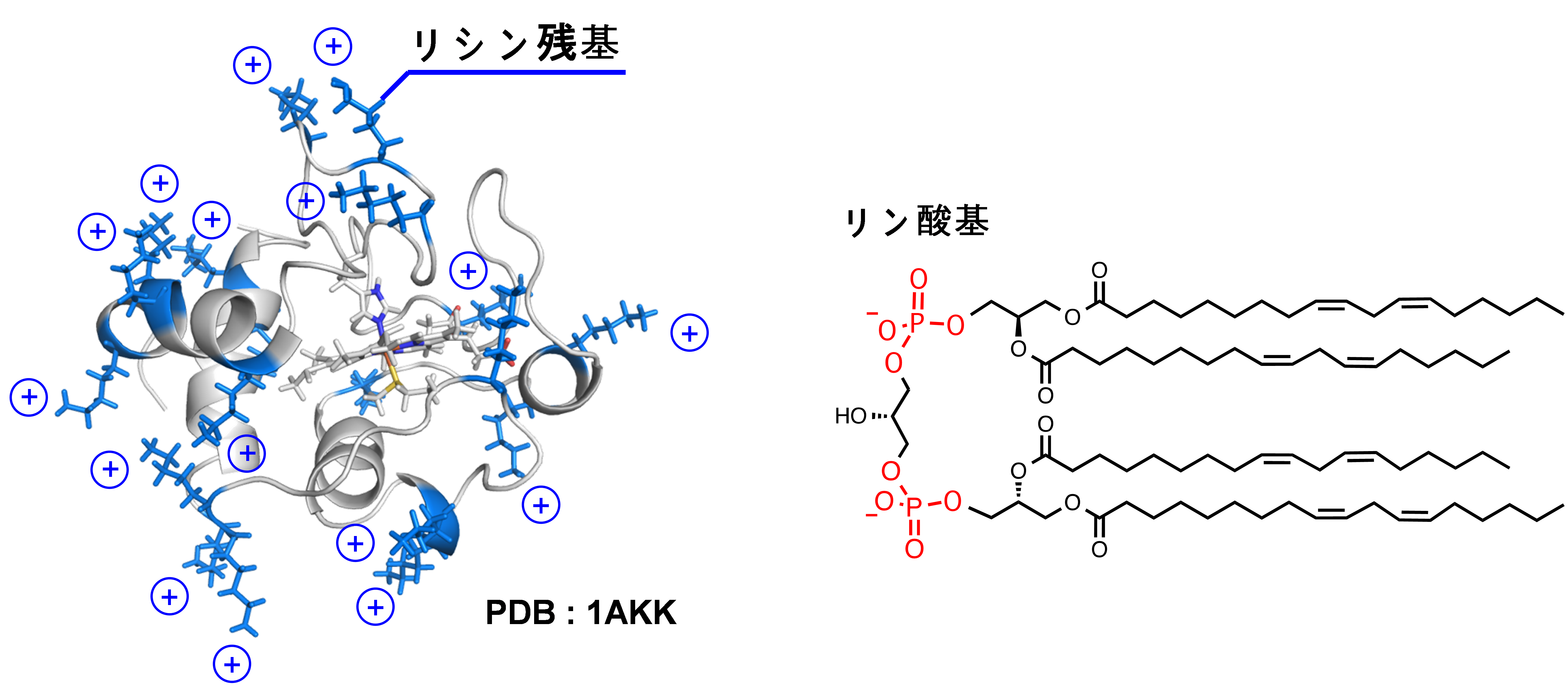
シトクロムcはミトコンドリアの脂質内膜でATP合成を担う呼吸鎖タンパク質の一員であり、正電荷をもつリシン残基を分子表面に多く有しています(図1)。一方、カルジオリピンはミトコンドリアの脂質内膜に特異的に存在するリン脂質であり、不飽和アシル鎖と負電荷をもつリン酸基を有しています(図1)。
細胞呼吸において、シトクロムcはカルジオリピンと結合し、ミトコンドリアの呼吸鎖タンパク質のうちシトクロムbc1複合体(複合体III)から電子を受け取り、シトクロムcオキシダーゼ(複合体IV)に渡しています。また、シトクロムcのミトコンドリアの脂質内膜への結合は、呼吸鎖タンパク質が起こす反応に伴って生成するROSの除去や、アポトーシスのトリガーとなるカルジオリピン酸化にも重要です。しかしこれまでの研究から、シトクロムcと複合体Ⅲあるいは複合体IVの相互作用部位については調べられていましたが、比較的小さい分子の観測を得意とするNMRとこれまで研究に用いられてきた巨大分子リポソーム(一般的に直径50ナノメートル以上)の組み合わせでは相互作用部位が観測しにくいため、シトクロムcとカルジオリピンの相互作用部位は特定されていませんでした。
廣田教授と長尾助教らは、NMRで観測可能なサイズの小さいモデル脂質膜をカルジオリピン分子数を制御してつくり、NMRと組み合わせることでタンパク質―脂質膜相互作用を原子レベルで解析可能な新しい方法を開発し、シトクロムcと脂質膜中のカルジオリピンとの相互作用部位を特定しました(図2、3)。
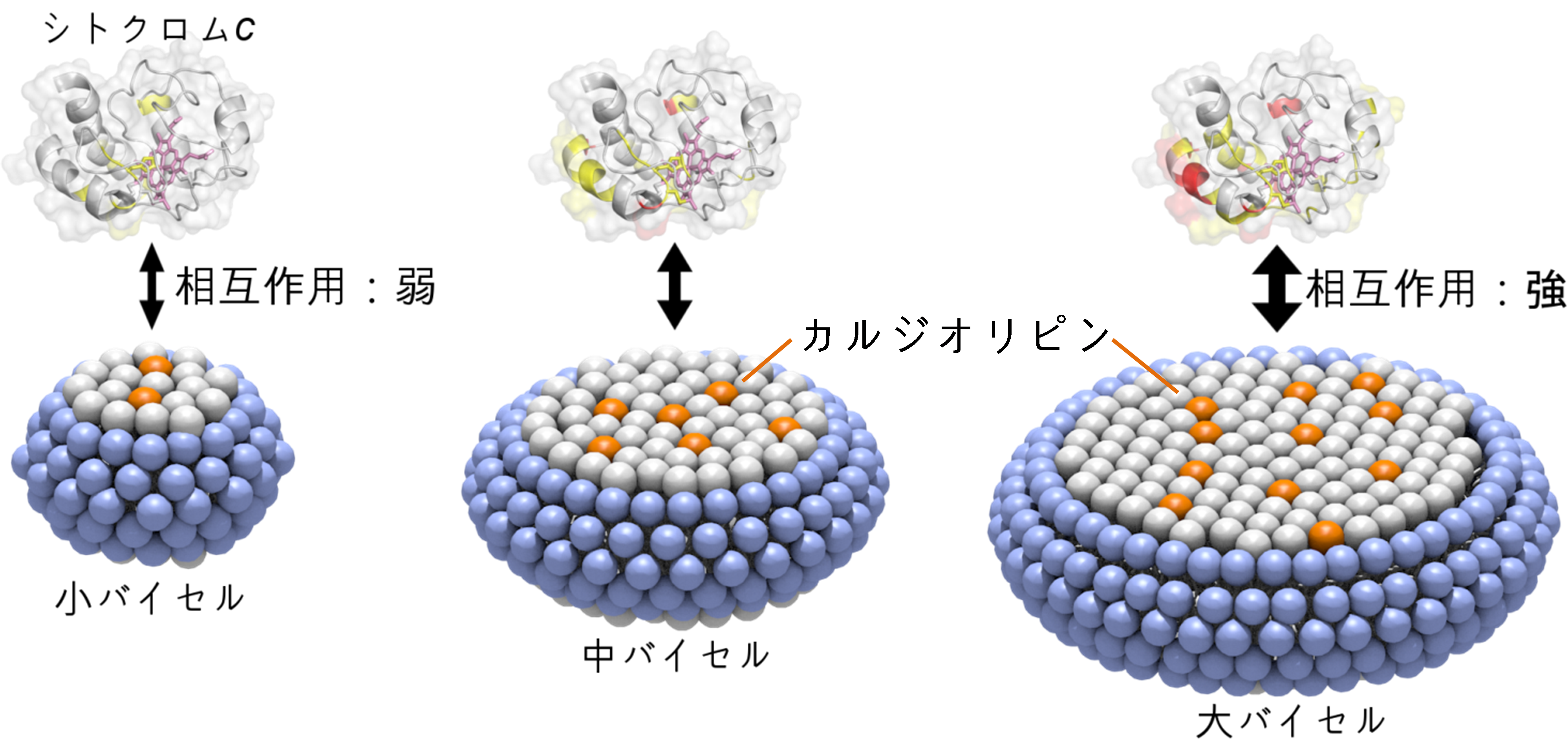
まず、シトクロムcと相互作用する脂質膜中のカルジオリピン分子数を制御したバイセルを作製しました。バイセルとは、短いアシル鎖をもつ脂質分子がディスクの縁に、長いアシル鎖をもつ脂質分子がディスクの平面に集まることにより自発的に形成されるディスク状の脂質膜であります(図3)。カルジオリピンをバイセルに加えると、カルジオリピンのアシル鎖が長いためにバイセルの平面部分に取込まれます。このバイセルの性質を利用して、平均粒径が9.14ナノ(10億分の1)メートル(大バイセル)、6.74ナノメートル(中バイセル)、4.73ナノメートル(小バイセル)の3種類のバイセルをカルジオリピン濃度が同じになるように作製しました。
シトクロムcとカルジオリピンの相互作用部位の特定は分子を構成する原子核の情報が得られる「NMR」という手法を用いて調べました。シトクロムcを安定同位体の15N窒素で標識すると、タンパク質中のアミノ酸残基1つ1つからNMRシグナルが観測されます。これらのNMRシグナルが観測されるスペクトル上での位置を化学シフトと呼び、化学シフトは各アミノ酸残基の置かれている環境を反映します。そのため、バイセルを加えたときにNMRシグナルの化学シフトが大きく変化したアミノ酸残基はカルジオリピンとの相互作用に関わっていることが分かります。
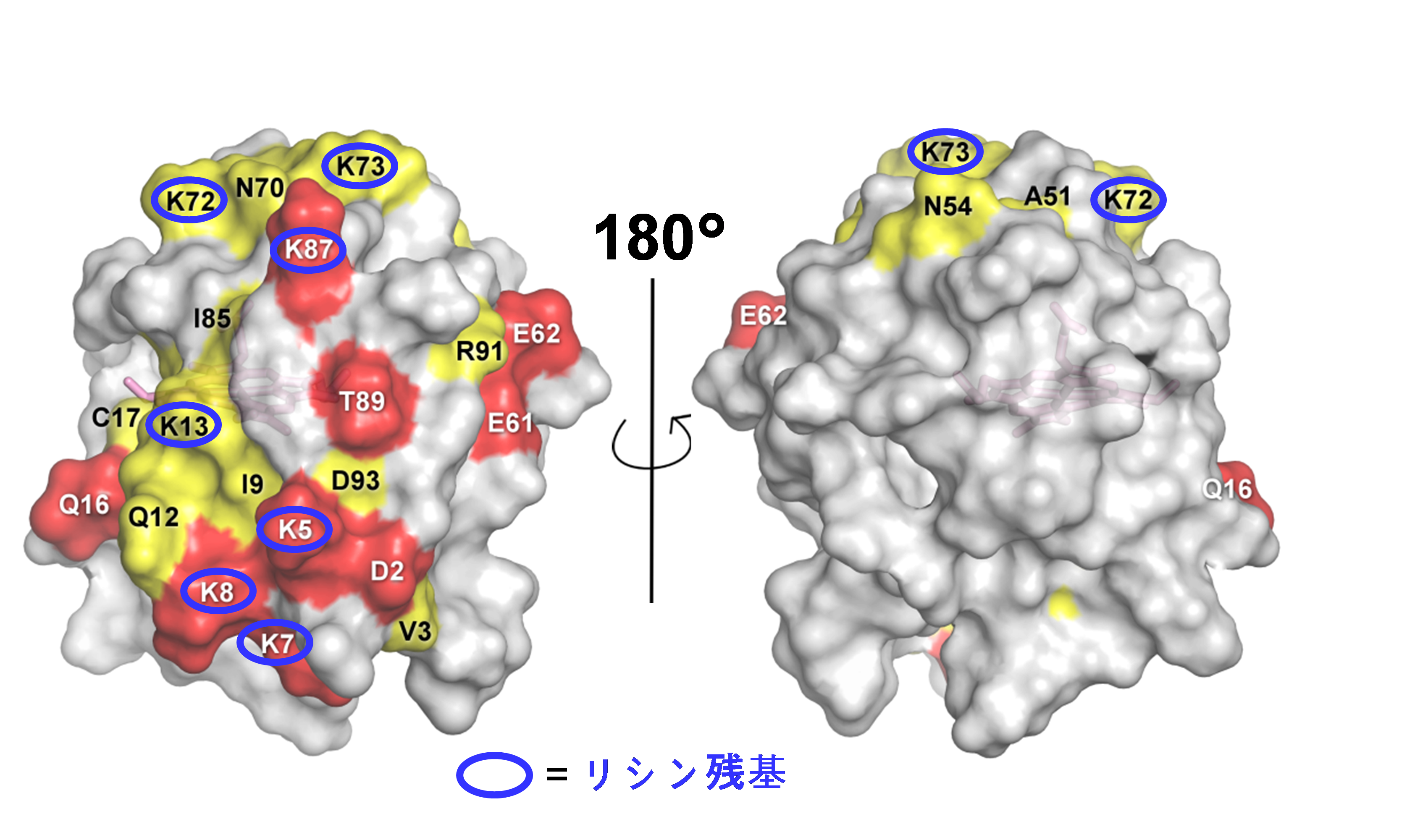
大バイセルをシトクロムcに加えた場合、シトクロムcがN末端から数えて5、7、8、13、72、73、87番目のリシン残基(Lys5、Lys7、Lys8、Lys13、Lys72、Lys73、Lys87)を含む広い分子表面でカルジオリピンと相互作用していることが明らかとなりました(図2)。また、シトクロムcに加えるバイセルを中バイセル、小バイセルと小さくするとこの相互作用は弱くなっていくことが分かりました(図3)。さらに、Lys8とLys72をそれぞれ欠損させた変異型シトクロムcでは、大バイセルを加えてもカルジオリピンとの結合が弱いことが分かりました。つまり、カルジオリピンが脂質膜に含まれる分子数が多い場合にシトクロムcと脂質膜の結合が強くなり、この結合には複数のリシン残基が関わっていることが明らかとなりました。
こうしたことから、シトクロムcが脂質膜に強く結合するためには、複数のリシン残基が協同的にはたらき、多くのカルジオリピン分子が必要であることを明らかにしました。
【研究の位置づけ】
生体内では通常、細胞の生と死のプロセスが厳密に制御されていますが、何らかの異常によりこのバランスが崩れると、癌や自己免疫疾患、臓器不全など様々な重い疾患になります。このバランスが崩れる原因の1つに、ミトコンドリアの脂質内膜でのシトクロムcの機能不全が関わっています。シトクロムcの機能にミトコンドリアの脂質内膜に含まれるカルジオリピンとの結合が重要であることは知られていましたが、シトクロムcが脂質膜にどのように結合しているかは解明されておらず、原子レベルでの詳細な解析が必要とされていました。
本研究により、シトクロムcが細胞膜と相互作用する部位の詳細が初めて明らかとなり、カルジオリピンと強く結合するためには、シトクロムcの広い分子表面の複数のリシン残基が多数のカルジオリピン分子と相互作用することが必要であることが明らかになりました。この情報はシトクロムcがミトコンドリア内膜でどのように電子輸送やROSの除去、カルジオリピン酸化によるアポトーシスの促進を行っているかを明らかにする手がかりとなり、これらが関わって起こる疾患のメカニズム解明に繋がると期待されます。
【用語解説】
1.ミトコンドリア
ミトコンドリアは真核生物の細胞内器官の1つで、外膜と内膜という2つの膜とそれらの間の膜間部、内膜に囲まれたマトリックス部分から成っています。内膜では、複合体I、複合体II、複合体III、シトクロムc、複合体IVなどの呼吸鎖タンパク質が電子伝達を行い、酸素消費とATP合成を行っています(図4)。シトクロムcは内膜のカルジオリピンと相互作用しています。
2.カルジオリピン
カルジオリピンは2つのリン酸基と4つの不飽和アシル鎖を有する脂質分子で(図1)、ミトコンドリアの内膜に存在しています。カルジオリピンは呼吸鎖タンパク質の機能に重要であるとともに、ROSやシトクロムcによって酸化されることでアポトーシスを促進することが知られています。
3.核磁気共鳴分光法(NMR)
NMRは、分子を構成する原子の核スピンの挙動から、それぞれの原子の化学結合などの情報を得る空間分解能の高い分光法の1つです。大きく分類すると、水などの溶媒中で試料を測定する溶液NMRと固体の試料を測定する固体NMRに分けられます。15Nなど核スピンを有する安定同位体で標識したタンパク質をNMRで観測すると、タンパク質中のほぼすべてのアミノ酸残基の情報が得られるため、タンパク質の立体構造を決定する方法として用いられています。
4.バイセル
バイセルはディスク状の構造をもつ脂質膜であり、短いアシル鎖をもつ脂質がディスクの縁、長いアシル鎖をもつ脂質が二分子膜となりディスクの平面を形成しています(図3)。短いアシル鎖をもつ脂質と長いアシル鎖をもつ脂質の混合比を変えることにより、数ナノから数十ナノメートルの間で均一なサイズのバイセルが調製可能です。
【論文情報】
(1) Title : Characterization of the Cytochrome c Membrane-Binding Site Using Cardiolipin-Containing Bicelles with NMR (2) DOI : http://dx.doi.org/10.1002/ange.201607419
naistar:http://hdl.handle.net/10061/11025 (NAIST Academic Repository:naistar)
(3)書誌情報 : Hisashi Kobayashi, Satoshi Nagao, Shun Hirota; Angewandte Chemie International Edition, 10 October 2016 online.
【本研究内容についてコメント出来る方】
北海道大学 大学院理学研究院 化学部門
教授 石森 浩一郎
E-mail:koichiro@sci.hokudai.ac.jp
【本プレスリリースに関するお問い合わせ先】
奈良先端科学技術大学院大学 物質創成科学研究科 超分子集合体科学研究室
教授 廣田 俊、 助教 長尾 聡
TEL:0743-72-6110 FAX:0743-72-6119
E-mail:hirota@ms.naist.jp
<報道担当>
奈良先端科学技術大学院大学 企画総務課 広報渉外係
小西 健
TEL:0743-72-5026、5112 FAX:0743-72-5011
E-mail:s-kikaku@ad.naist.jp
【解説図】
図1.シトクロムc(左)とカルジオリピン(右)の分子構造
図2.シトクロムcとカルジオリピンの相互作用部位
図3.シトクロムcとカルジオリピンの相互作用のバイセルサイズ依存
図4.呼吸鎖タンパク質間の電子輸送程