2018/03/06
有効なインスリンを細胞内で正確に作る
タンパク質群誘導の新たな機構を解明
~糖尿病創薬へ期待~
【概要】
奈良先端科学技術大学院大学(奈良先端大、学長:横矢 直和)研究推進機構 河野特任プロジェクトの河野憲二特任教授と土屋雄一研究員、京都薬科大学の斉藤美知子准教授らは、血糖値を下げるホルモンのインスリンを体内で合成する際に、分子の正しい立体構造を効率よく整える新たな仕組みを明らかにした。インスリンなどの分泌タンパク質は、細胞内の製造工場である小胞体と言う小器官で作られたあと、厳密な品質管理チェックを受け、分子の立体構造が正確に折りたたまれているものだけが分泌されるが、研究グループは、その働きの中枢を担う親方ともいえるタンパク質(IRE1、アイアールイーワン)が、インスリン分子の折りたたみを行う職人役のタンパク質を統率制御していることを突き止めた。さらに、この親方タンパク質や職人タンパク質が働かなくなると、インスリン産生分泌に異常を生じて高血糖の状態になり、糖尿病を発症することも、IRE1遺伝子を壊したノックアウトマウスを用いて証明した。ヒトの糖尿病でもIRE1経路(ストレス応答経路の1つ)の活性低下が報告されており、正常なインスリン分泌を維持するためにIRE1経路の恒常的活性化が大変重要と考えられる。これにより、糖尿病の創薬につながることが期待される。この研究成果は、3月5日のJournal of Cell Biology誌(米国)のオンライン版で速報掲載される。【掲載雑誌のプレス解禁日時:平成30年3月5日(月)午後11時(日本時間)】
【解説】
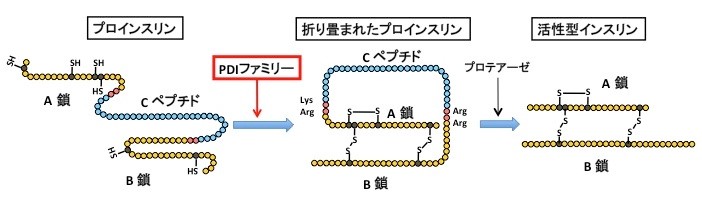
インスリンは、血糖値を下げる作用を持つ唯一のホルモンであり、膵臓のランゲルハンス島(膵島)にあるβ細胞でのみ合成される。その分泌量や作用の低下は高血糖をもたらし糖尿病を引き起こすため、重度の糖尿病患者にはインスリン投与が必要とされる。インスリンは膵島β細胞の小胞体(1)で、86個のアミノ酸がつらなったインスリンの前駆体であるプロインスリンとして合成され、正確に折りたたまれ正しい立体構造をとる(図1)。この立体構造形成にはシステインと呼ばれるアミノ酸間の結合形成(ジスルフィド結合(2); S-S結合)が重要であり、この反応はPDI (protein disulfide isomerase; プロテインジスルフィドイソメラーゼ(3))と呼ばれる酵素ファミリーに属する分子により形成される(図1)。プロインスリンは分子内に3つのS−S結合をもつことが知られており、正しいS−S結合形成が最終的なインスリン形成のために必須である。インスリンは生存に必須のホルモンであり、合成や分泌の機構に関しては今まで精力的に解析されてきているが、インスリンを折りたたむ過程に必要な"職人"とその "親方"については未解明な点が多かった。
今回、私たちはインスリンの産生と分泌を担う膵島β細胞で、分泌タンパク質の品質管理をになう親方の役目をしているIRE1α(アイアールイーワンアルファ)(4)という小胞体タンパク質が、生理的条件下で恒常的に活性化していることを見出した(図2)。通常この親方は、細胞に緊急事態(小胞体ストレス)が生じない限りは働くことはないので、常に精力的に働いている理由について解析を進めた。その結果、IRE1αはインスリンの前駆体を折りたたむステップに大きく貢献していることがわかった。さらにIRE1α制御下の因子を調べたところ、5人の職人達(PDI ファミリー分子)が特定された。これらの結果から、IRE1αは、膵島β細胞では5つのPDIファミリー分子(PDI, PDIR, P5, ERp44, ERp46)を常に誘導発現することで、プロインスリンの正しい立体構造形成能力を維持しており、もしこの経路に欠陥が生じるとインスリン分泌が低下し糖尿病を発症することが明らかとなった(図3)。ヒトの糖尿病でもIRE1経路(ストレス応答経路の1つ)の活性低下が報告されており、正常なインスリン分泌を維持するためにIRE1経路の恒常的活性化が大変重要と考えられる。
【実験の手法】
マウスを哺乳動物のモデル生物として用い、膵島β細胞特異的にIRE1α遺伝子を欠損させた際に示す表現型を解析した。次にそのマウスから膵臓β細胞のモデル細胞株を作製し、さらに詳しい解析を行った。
【実験の結果】
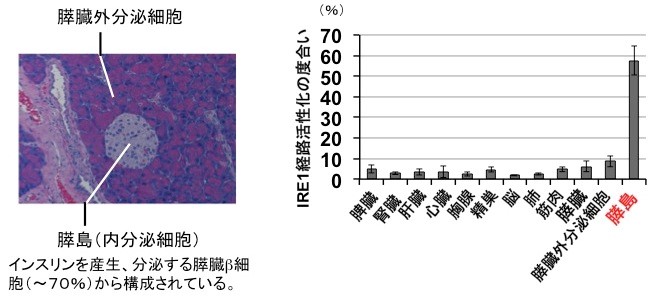
私たちは他の組織に比べ、膵島β細胞では非常に高いレベルでIRE1αが恒常的に活性化していることを見出した。この生理的意義を明らかにするために、膵島β細胞特異的にIRE1αを欠損する遺伝子ノックアウトマウスを作製したところ、この遺伝子欠損マウスは、生後4週齢あたりからインスリンの生産及び分泌量の低下が原因で糖尿病を発症することが判明した。インスリン生産低下の原因を詳しく調べたところ、プロインスリン(インスリン前駆体)の合成ではなく、折りたたみのステップ効率が顕著に落ちていることがわかった。さらに詳細に解析したところ、活性化しているIRE1αは小胞体で働く5つの折りたたみ促進酵素(5つのPDIファミリー:PDI、PDIR、P5、ERp44、ERp46)の発現誘導を指揮しており、IRE1αが働かないと、これら5つの分子が不足しプロインスリンのS-S結合形成が正常に進まず、結果としてインスリン産生量が激減し、マウスは出生後1ヶ月程度から糖尿病を発症することが明らかとなった。逆に、これら5つの酵素を膵島β細胞に過剰発現すると、インスリン産生が上がることも確認した。以上の結果は、膵島β細胞ではIRE1α経路の恒常的な活性化が重要であり、これによりプロインスリンの折りたたみが正常に進み、成熟したインスリンが正常に産生されることが明らかとなった。
【本研究の意義】
-
プロインスリンの折りたたみには、20種以上あるPDIファミリーのうち特に5つの分子(PDI, PDIR, P5, ERp44, ERp46)が重要な働きをしていることを初めて報告した。
-
ストレス応答に関るIRE1α分子は、膵島β細胞では常に活性化状態にあり、上記5つのPDI分子を発現誘導することで効率よいプロインスリンの折りたたみを促進し、インスリン分泌を正常に保っていることを初めて示した。
-
IRE1α経路の活性化を自由に制御できる低分子の開発は、糖尿病治療薬の開発につながる可能性がある。
【本研究の主な研究助成金】
日本学術振興会 科学研究費助成事業
1 基盤研究(S) 「小胞体ストレス応答の分子機構とその破綻による疾患機序の解明」
研究代表者:河野憲二(奈良先端科学技術大学院大学)
2 新学術領域研究「新生鎖の生物学」
計画研究代表者:河野憲二(奈良先端科学技術大学院大学)
民間財団研究助成金
武田科学振興財団:生命科学研究助成
研究代表者:河野憲二(奈良先端科学技術大学院大学)
【補足説明】
-
小胞体
多くの分泌タンパク質(インスリン、抗体、消化酵素、膜受容体)は、細胞内の小胞体と呼ばれる細胞小器官で合成され、機能的な立体構造へと折りたたまれる -
ジスルフィド結合(S-S結合)
ジスルフィド結合は、タンパク質の翻訳後修飾の一つで、タンパク質のSH基同士が共有結合(S-S結合)を形成した状態のことをいう。小胞体で折りたたまれるタンパク質の多くがジスルフィド結合を形成することで正しく折りたたまれる。インスリンは3つのジスルフィド結合により正しい立体構造を維持している。 -
PDIファミリー(プロテインジスルフィドイソメラーゼファミリー )
PDIファミリーはタンパク質の正しいS-S結合形成を促進する折りたたみ酵素である。哺乳動物では約20種類を超えるPDIファミリーが見つかっているが、それぞれの機能的違いは詳しく分かっていない。 -
アイアールイーワンアルファ(IRE1α)
小胞体膜に局在する膜貫通タンパク質で、小胞体ストレス時に活性化し小胞体機能に関連する遺伝子群を誘導することで、小胞体の恒常性維持に働いている。
【解説図】
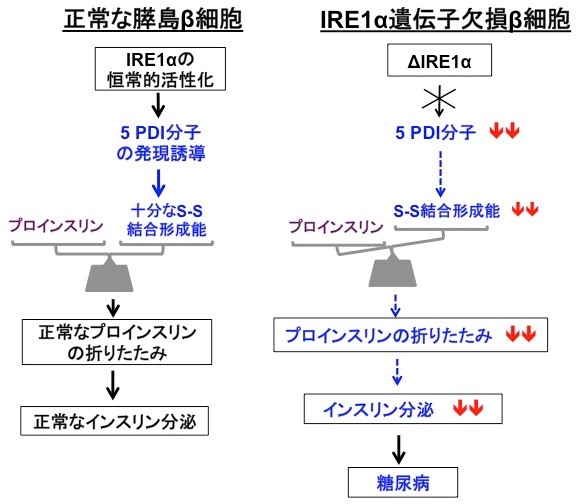
促進している。
(右図)膵島β細胞でIRE1αが働かなくなると、5つのPDIファミリーが低下し、結果的にプロインスリンの折りたたみ
とインスリン量の低下が起こり、糖尿病を発症する。
【共同研究者】
京都薬科大学 バイオサイエンス研究センター 斎藤美知子 准教授
東北大学 多元物質科学研究所 門倉広 准教授
大阪大学大学院 医学系研究科 宮崎純一 教授、田代文 研究員
大阪国際がんセンター研究所 今川佑介 研究員
金沢医科大学 総合医学研究所 岩脇隆夫 教授
【掲載論文】
タイトル IRE1-XBP1 pathway regulates oxidative proinsulin folding in pancreatic β cells.
著者 Yuich Tsuchiya, Michiko Saito, Hiroshi Kadokura, Jun-ichi Miyazaki, Fumi Tashiro, Yusuke Imagawa, Takao Iwawaki, Kenji Kohno
掲載誌 Journal of Cell Biology
naister:http://hdl.handle.net/10061/12215(NAIST Academic Repository:naistar)
【お問い合わせ先】
奈良先端科学技術大学院大学 研究推進機構 河野特任プロジェクト研究室
氏名:河野 憲二 特任教授
TEL:0743-72-6207、-6230、-5903 FAX:0743-72-5615
E-mail:kkouno@bs.naist.jp






