2018/10/17
神経細胞が脳内を移動するための仕組みを解明
~移動に必要な推進力を生み出す分子が明らかに~
脳疾患解明への応用に期待
【概要】
奈良先端科学技術大学院大学(奈良先端大、学長:横矢 直和) 先端科学技術研究科 バイオサイエンス領域の嶺岸卓徳研究員、稲垣直之教授、名古屋市立大学大学院 医学研究科の澤本和延教授らのグループは、神経細胞が脳内で移動する際に、その推進力を生み出す鍵となる分子を発見し、神経細胞を移動させて的確に目標の場所に到達させるための新しい仕組みを明らかにしました。また、この分子が働かなくなると、神経細胞が正しい場所をめざして移動できなくなり、その結果、脳の奇形が起こることも突き止めました。
わたしたちの脳内では、数多くの神経細胞が連携して神経ネットワークを形成し、生きるために必要な知覚など脳の高次機能活動を支えています。神経細胞は、発生の過程で脳の形成のために脳内で大規模な移動を行うことが知られており、目的地に到着後は、そこで神経細胞の軸索と樹状突起を伸ばして神経ネットワークを形成します。また、大人になっても脳の一部では神経細胞が継続して移動し、神経ネットワークの形成と維持を支えます。神経細胞は、移動の際に進行方向に向かって先導突起と呼ばれる突起をダイナミックに伸ばしたり縮めたりして、シャクトリムシのように目的地に向かって這ってゆきます。しかし、神経細胞が移動するための推進力を生み出す仕組みはよくわかっていませんでした。
そこで稲垣教授らは、先導突起の先端で「シューティン1b」という分子が濃縮されることにより神経細胞の移動に必要な推進力を生み出すことを見つけ、その仕組みを解明しました。また、この分子が働かないマウスの脳内では、神経細胞が目的地に到達できず、脳の奇形が起こることも突き止めました。
本研究の成果により、脳の形成やヒトの脳疾患についての理解が深まります。この研究成果は平成30年10 月16 日(火)午前11 時(現地時間)に米国科学雑誌Cell Reports に掲載されました。
【解説】
研究の背景
脳が正しく形成されて活動できるようになるためには、神経細胞が脳の正しい場所に移動して移動先で軸索と樹状突起を伸ばして神経ネットワークを構築することが必要です。神経細胞は、先導突起(用語解説1)の伸長と細胞体の牽引の2 つのステップを繰り返すことでシャクトリムシのように目的地に向かって移動します (図1A)。しかし、神経細胞が移動するための推進力を生み出す分子の仕組みはよくわかっていませんでした。また、稲垣教授らのグループはこれまでに、「シューティン1b」(用語解説2)というタンパク質を発見していましたが、その機能は不明でした。そこで、今回、研究グループはシューティン1b の脳における働きを調べました。
研究の手法
実験では、シューティン1b の脳における働きを調べるために、この分子を作る遺伝子を壊した「シューティンノックアウトマウス」の脳や脳内における神経細胞の分布を解析しました。また、このマウスから採取した神経細胞を正常な野生型マウスの脳内に移植し、脳切片を作成してライブイメージングを行うことにより、神経細胞内でのシューティン1b の機能不全が引き起こす異常を調べました。さらに、蛍光タンパク質を融合させたシューティン1b を用いて、分子が発する蛍光を追跡することで神経細胞内におけるシューティン1b の挙動を解析し、牽引力顕微鏡法(用語解説3)により神経細胞が移動する際に発生する力の計測を行いました。
結果
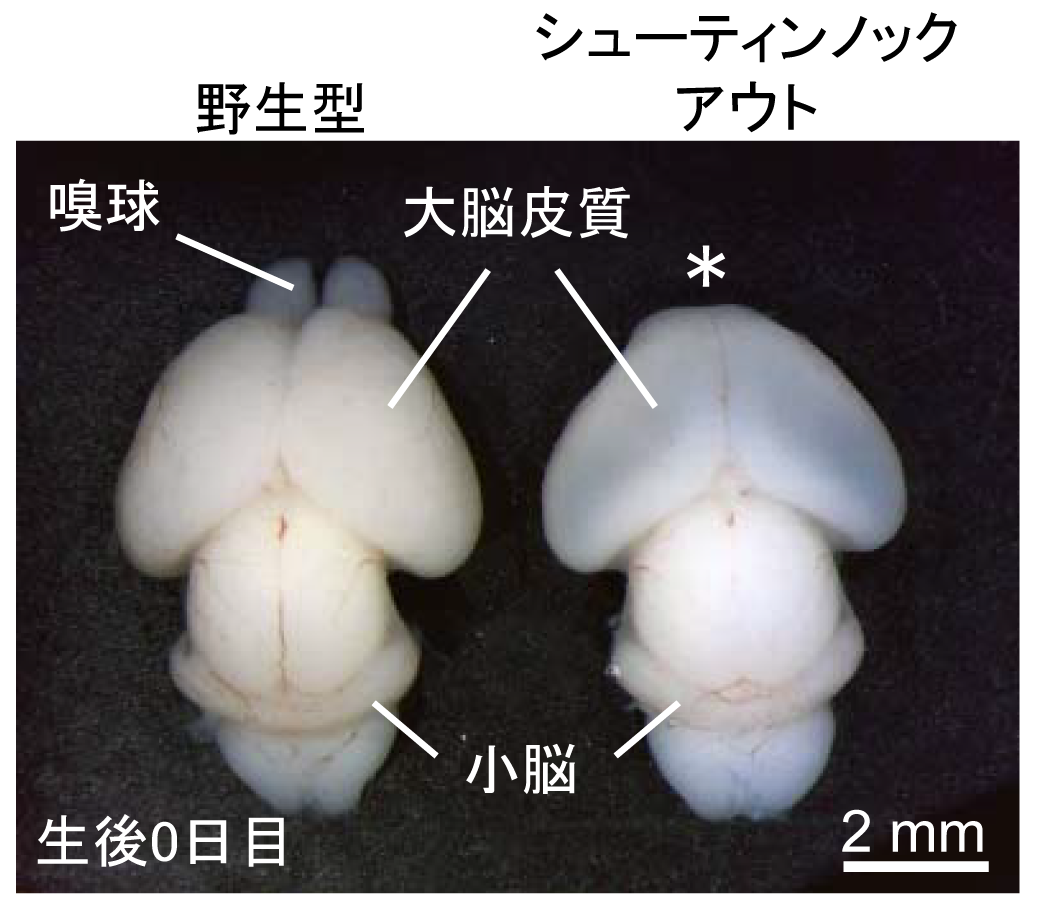
シューティン1b が働かないシューティンノックアウトマウスの脳では、嗅覚を担う嗅球 (用語解説4)と呼ばれる脳組織の形成不全が起こることを見出しました(図2)。また、シューティンノックアウトマウスの脳内では、嗅球神経細胞が嗅球に移動できずに異常な場所に分布していました。このため、嗅球神経細胞の動きをライブイメージングで解析をしたところ、シューティン1b が働かない神経細胞では先導突起の伸長と細胞体の牽引が阻害され移動速度が遅くなることがわかりました。さらに、蛍光タンパク質融合シューティン1b を用いたライブイメージング解析により、シューティン1b が先導突起の先端に濃縮することで先導突起が伸長することが解明されました (図1B)。また、先導突起の先端では、シューティン1b が先導突起の伸長に必要な力を生み出し(図3)、さらにこの力を推進力として細胞体の牽引を促すことが明らかとなりました (図4)。以上の結果から、シューティン1b が神経細胞の移動の推進力を生み出し、神経細胞の移動や脳の形成に重要なタンパク質であることを突き止めました。
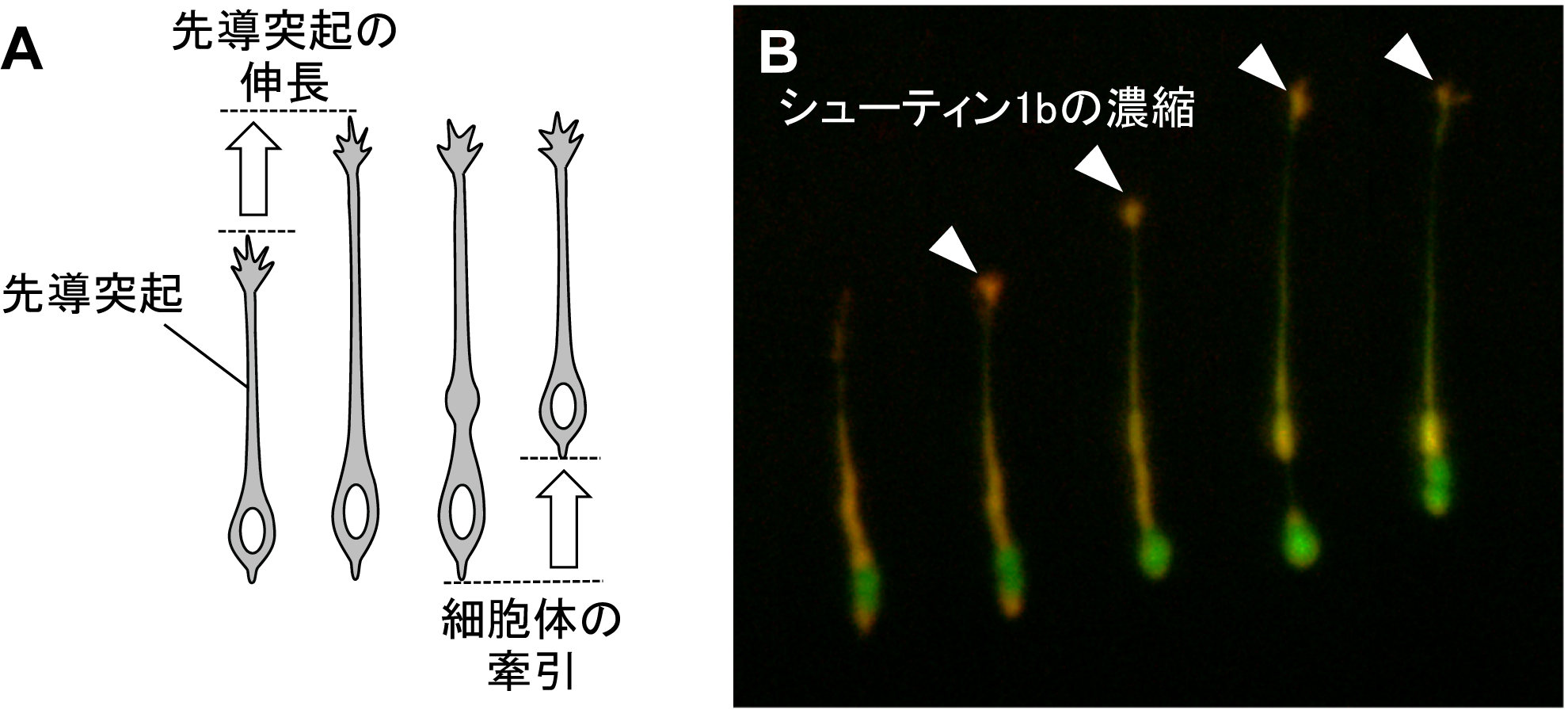
A. 神経細胞は先導突起の伸長と細胞体の牽引の二つのステップを繰り返して移動する。
B. 蛍光タンパク質mRFP 融合シューティン(赤)が先導突起の先端に濃縮する(矢頭)と先導突起が伸長する。緑は、細胞全体をラベルした蛍光タンパク質AcGFP の蛍光を示す。左から右に向けて約30分ごとの時間間隔で撮影した。
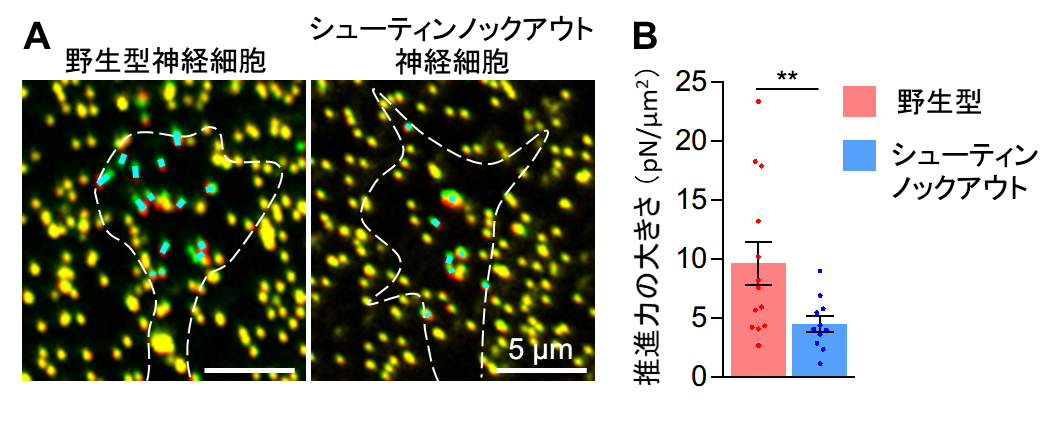
A. 牽引力顕微鏡法による先導突起先端で生み出される力の計測。水色線の長さは発生した力の大きさを表す。白色破線は先導突起の先端を表す。緑色は力の測定のために用いた蛍光ビーズの位置(原点)で、赤色はビーズの原点からの移動を示す。力はビーズの移動距離から計算できる。
B. シューティンノックアウト神経細胞では、先導突起先端で生み出される移動のための推進力が減少する。
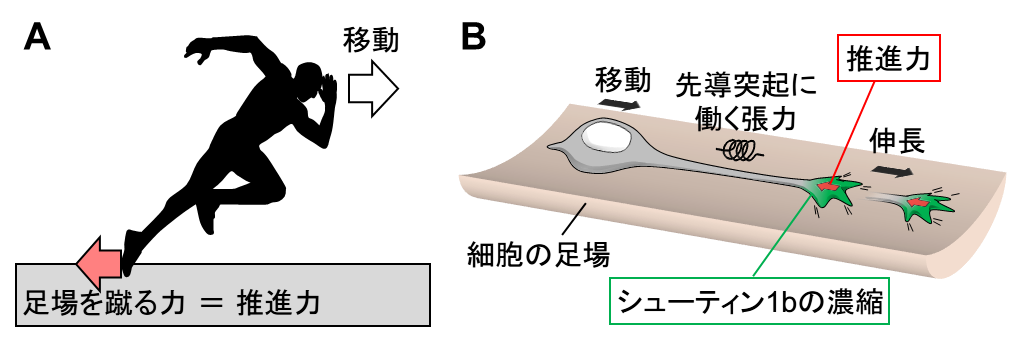
A. 私たちが走るときは、足場を蹴ることで移動のための推進力を生み出す。
B. 同様にシューティン1b が先導突起の先端で足場を蹴る力を生み出すことで移動のための推進力が生まれる。先導突起の先端で生まれた推進力は先導突起を伸長させる。その結果、先導突起に働く張力が増加し、細胞体が牽引される。
研究の意義と位置づけ
今回の研究は、神経細胞の移動に必要な推進力が生み出される仕組みを分子レベルで解明した点に意義があります。脳が形作られる時期では、異なる場所で生まれた様々な種類の神経細胞が、各々の目的地へ大規模に移動することで働きの異なる脳組織が形成されます。また、嗅球や記憶、学習を担う海馬といった脳の一部組織では、神経細胞が一生にわたり新しく生まれて目的地に移動します。そして、古い神経細胞との世代交代を通して神経ネットワークを上書きすることで、外部の環境に応じた最適な脳の情報処理システムを実現するのです。そのため、神経細胞の移動障害は脳の奇形や脳疾患の原因となります。今回の研究成果は、神経科学や発生学の発展のみならず、脳疾患の解明や神経再生の治療法開発といった医学領域の研究の加速も期待できます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMEDCREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣 直之)および日本学術振興会(JSPS)科学研究費、大阪難病研究財団、武田科学財団による支援によって実施しました。
【用語説明】
※1 先導突起:
移動する神経細胞が持つダイナミックに伸縮する突起。先端部が外部シグナルを感知するアンテナとして働くことで、神経細胞は正しい方向に移動できる。
※2 シューティン1b:
神経軸索の伸長とガイダンスを担うタンパク質シューティン1a のスプライシングバリアント(同じ遺伝子から作られる異なるタンパク質)として稲垣教授のグループで発見された(Higashiguchi et al., Cell Tissue Res., 2016)。シューティン1b は脳や末梢組織に広く発現するが、その機能は不明だった。
※3 牽引力顕微鏡法:
細胞を蛍光ナノビーズが包埋されたゲルの上で培養し、力の発生に伴うビーズの動きをコンピューター解析することで、細胞が生み出す力の大きさと方向を計測する手法。
※4 嗅球:
嗅覚情報の処理を担う脳組織の一つ。
【本プレスリリースに関するお問い合わせ先】
<研究に関する事>
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域
神経システム生物学研究室 教授 稲垣 直之
TEL:0743-72-5466
E-mail: ninagaki@bs.naist.jp
<報道に関する事>
奈良先端科学技術大学院大学 企画総務課 広報渉外係
TEL: 0743-72-5026 FAX: 0743-72-5011
E-mail: s-kikaku@ad.naist.jp
【AMED 事業に関するお問い合わせ先】
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask@amed.go.jp
【発表雑誌】
(1) Title : Shootin1b Mediates a Mechanical Clutch to Produce Force for Neuronal Migration
(2) DOI : https://doi.org/10.1016/j.celrep.2018.09.068
(3)書誌情報 : Minegishi Takunori, Uesugi Yasuyuki,Kaneko Naoko, Yoshida Wataru, Sawamoto Kazunobu & Inagaki Naoyuki; Cell Reports, 25(3),624-639.e6, 16 October 2018.
naister:http://hdl.handle.net/10061/12602(NAIST Academic Repository:naistar)






