2009/01/05
【概要】
大きな分子であるタンパク質の立体構造を構成する水素結合(水素同士の結合)は複雑な立体構造を保ち、酵素として触媒反応を行う際にも 重要な役割を担っている。その水素結合のなかでもひときわ高いエネルギーで結びついた「低障壁水素結合」(LBHB)という特殊な相互作用が蛋白質にも存 在していることが世界で初めて証明された。この成果は、奈良先端科学技術大学院大学(学長:安田 國雄)物質創成科学研究科博士後期課程3年山口繁生、上久保裕生准教授、片岡幹雄教授(日本原子力研究開発機構客員研究員を兼任)の研究グループが、独立 行政法人日本原子力研究開発機構(理事長:岡﨑俊雄)量子ビーム応用研究部門中性子生命科学研究ユニット生体分子構造機能研究グループ黒木良太研究主席、 栗原和男研究副主幹との共同研究で、細菌の光走性に関わる光受容タンパク質(イェロープロテイン)を材料に、高分解能中性子結晶構造解析という方法を使 い、成功したもの。特殊な結合は仮説として存在が予想されながら、見つからないため20年にわたる論争が続いていた。今回の研究では、低障壁水素結合が関 与する光情報伝達の新たなメカニズムも提案した。
「低障壁水素結合」は、高圧下や結晶の内部など特殊な条件下においた有機低分子で形成されるこ とは知られていた。蛋白質では、1990年ごろから、消化酵素が反応する際に、途中でできる中間体内部で過渡的に形成され、触媒反応を引き起こしているこ とが提唱されているが、直接的な証明はなく、存在するかどうか論争になっていた。今年、ノーベル化学賞を受賞した下村脩・ボストン大学名誉教授が発見した オワンクラゲの緑色蛍光タンパク質(GFP)の発光も「低障壁水素結合」が関係しているとされている。
今回の研究では、イェロープロテインが反応していない状態(基底状態)でも低障壁水素結合が存在していることを突き止めた。さらに、これまで活性中心の負イオンと対になるイオンと考えられていたアルギニンが正に帯電していないことを明らかにした。
こ れにより、低障壁水素結合が、タンパク質分子内部のイオンになりにくい疎水的環境でも、孤立した負電荷を安定化させていること、光を吸収することにより通 常の水素結合に変わることで、光情報が蛋白質に伝わると言うこれまで知られていなかったメカニズムを提唱することに成功した。また、低障壁水素結合が形成 される要因も明らかにした。
この研究成果は、蛋白質の構造安定性や機能発現の分子機構の理解を深めるばかりでなく、低障壁水素結合を任意に作り出すことによって、より強固な分子間相互作用を設計するという新しい創薬のデザイン原理を与えると期待される。
なお、本研究成果は、平成21年1月2日(金)にアメリカ科学アカデミー紀要(Proceedings of National Academy of Science, U. S. A.)電子版に掲載されました。
【解説】
タンパク質の機能のほとんどが、構成する分子から水素原子が抜け出すか、吸着するかの反応で進行する。この反応は主に水素結合を介して起きる。したがって、蛋白質の機能のメカニズムを理解するためには、水素原子の位置を含めて構造を明らかにしなければならない。
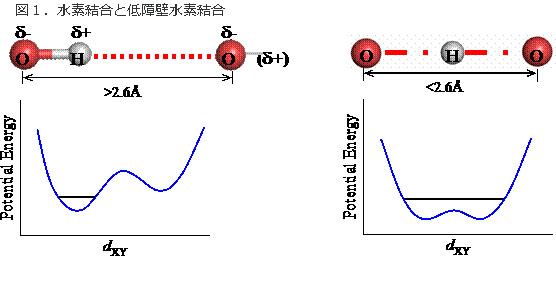
通常、タンパク質中でみられる水素結合は、ドナー(水素供与原子)と呼ばれる原子に共有結合した水素が弱く正に帯電し、他の弱く負に帯電したアクセプター(水素受容原子)と呼ばれる原子との静電相互作用によって生じる(図1左)。
一 方で、固体中の有機低分子などでは、ドナーとアクセプターの2つの原子に水素原子が同時に共有された「低障壁水素結合」が形成されることがある(図1 右)。通常の水素結合では、ドナーとアクセプターの距離(水素結合距離)は2.6~3.5 Å 程度、結合エネルギーは1モルあたり数キロカロリー程度であるのに対し、低障壁水素結合では、その距離は極端に短くなり、結合エネルギーも共有結合に匹敵 する(1モルあたり数10キロカロリー)。
それに加え、水素原子が2つの高い負の電荷を持つ原子に共有されることによって、これらの原子のほぼ中心付近に存在する。従って、通常の水素結合と「低障壁水素結合」は、水素原子位置を指標として区別することができる。
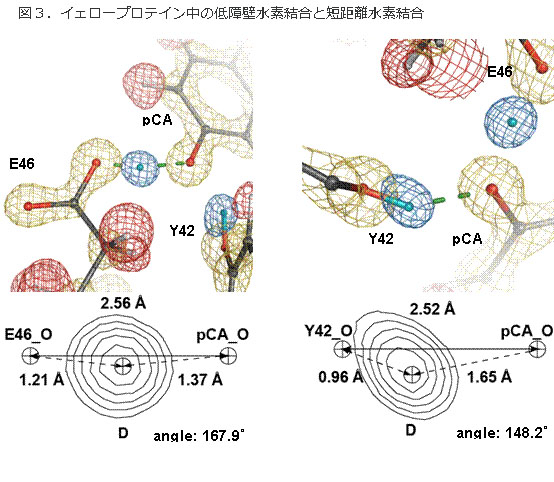
タ ンパク質においても、1990年代、セリンプロテアーゼなどで、低障壁水素結合の特徴の一つである、短い水素結合距離を示す水素結合の存在が報告され、低 障壁水素結合のもつ高い結合エネルギーが、高効率な触媒反応を実現しているとの仮説が提唱されていたが、その存在は証明されていなかった。タンパク質中の 水素原子は、X線構造解析など従来の測定手法では直接観測することが困難である(図2)。片岡教授らは、世界に先駆けて、中性子結晶構造解析と高分解能X 線結晶構造解析を併用した構造解析法を考案し、イェロープロテインに存在する、ほぼすべての水素原子位置を決定することに成功した。この結果、タンパク質 の基底状態で「低障壁水素結合」が存在することを世界で初めて証明した(図3)。
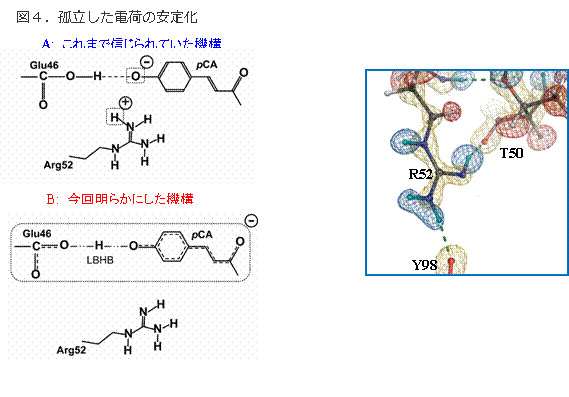
タンパク質内部は疎水的であるため、孤立した電荷は非常に不安定 な状態にある。このため、タンパク質内では、正のイオンと負のイオンが対になって存在している必要がある(対イオン)。イェロープロテインでも、反応中心 は負のイオンとなっており、対イオンにより孤立した負電荷が安定化されると信じられてきた。
今回、片岡教授らは、「低障壁水素結合」に加え、対イ オンと信じられていたアルギニンが電荷を持っていないことも明らかにした。これにより、「低障壁水素結合」自身が、タンパク質内の孤立電荷が安定化に寄与 していることが明らかとなり、蛋白質に対する新しい物理化学的な役割が始めて明らかにされたことになる(図4)。
さらに、本研究から、「低障壁水 素結合」は、2つの電気陰性度の高い原子が、同程度の水素原子親和性を示す時にのみ、生じる結合であることが明らかになった。水素原子に対する親和性は、 水素結合に関与する反応基の電子状態に密接に関係するため、外的刺激によって、反応基の電子状態が変化すれば、その大きな結合エネルギーに相反して、容易 に「低障壁水素結合」を切断することができる。イェロープロテインでは、この性質を利用し、反応中心が光を吸収することによって生じる電荷移動が、「低障 壁水素結合」から通常の水素結合へ切り替わり、タンパク質部分への迅速な光エネルギー・光情報移動を実現していることが明らかとなった(図5)。
こ れらの機構は、これまで、全く考えられてこなかったものであり、今回の低障壁水素結合の観測によって、初めて明らかにされた。これらの発見は、タンパク質 の触媒機構やエネルギー変換、情報伝達機構に対して新たな知見を与えただけでなく、今後、「低障壁水素結合」を考慮した新規の創薬デザイン法の考案につな がると期待される。
【用語解説】
「イェロープロテイン」
光合成細菌から見出された水溶性の光受容タンパク質。走光性や 光による遺伝子発現調節の光受容体であると考えられている。生物の光情報変換に携わる最も単純な蛋白質であるため、よく研究されている。また、その構造 は、生物界の情報伝達蛋白質に広く分布しているPASと呼ばれる構造モチーフの原型と考えられている。
「低障壁水素結合」
図の解説参照のこと。
「中性子結晶構造解析とX線構造解析」
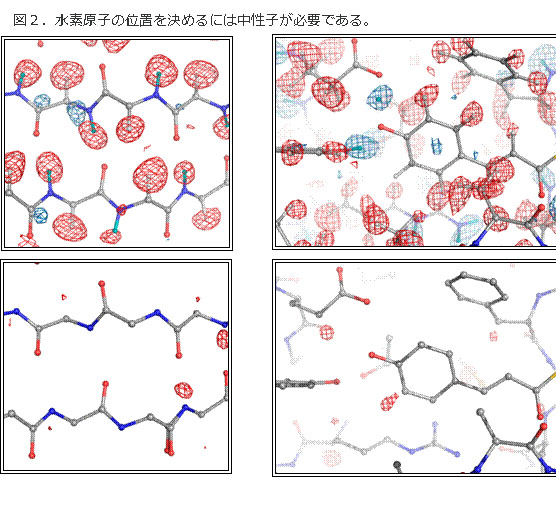
X 線は電子密度によって散乱されるため、その散乱能は原子番号に比例し、電子を1個しか持たない水素によってほとんど散乱されない。したがって、X線結晶構 造解析で水素原子を同定することは難しい。高分解能のX線結晶構造解析でも、炭素に共有結合した水素原子の一部は見ることができるが、水素結合に関与して いる水素原子はほとんど見ることができない(図2)。中性子は核力によって散乱されるため、原子番号依存性はなく、水素も炭素も酸素もほぼ同じ散乱能を示 す。さらに、水素と重水素の散乱能が大きく異なるために、水素原子の同定には中性子が向いている。中性子の実験のためには、原子炉や加速器が必要であり、 どこでもできるわけではない。世界に誇る原研のタンパク構造解析用中性子分光器BIXにより、今回の解析が可能になった。
【図解】
図1.水素結合と低障壁水素結合
水 素結合に関与する水素原子は、通常ドナーと呼ばれる原子(酸素や窒素)に共有結合している。アクセプターと呼ばれる原子との間で、弱い静電相互作用が働 き、水素結合を形成する(左)。このときドナーとアクセプターの距離は2.6Å以上である。ドナーとアクセプターの距離が近づくと、水素原子はドナーとア クセプターの間を簡単に行き来できるようなり(エネルギー障壁が低くなる)、低障壁水素結合を形成する(右)。しかし、距離が短ければ必ず低障壁水素結合 になるわけではない。本研究結果でも低障壁水素結合でない例が見えている。
低障壁水素結合は、結合エネルギーが高い、容易にプロトンの脱着を引き起こせる、等の性質があり、有機低分子の固相や気相での化学反応では重要であることが知られていたが、タンパク質内部では安定には存在し得ないと思われていた。
図2.水素原子の位置を決めるには中性子が必要である。
タ ンパク質の機能のほとんどが、水素原子の脱吸着で進行する。このために水素結合が重要な役割を果たす。このメカニズムを理解するためには、水素原子の位置 を含めて構造を明らかにしなければならない。4σレベルの密度地図(上図)で比較すると、タンパク質構造解析の王道であるX線結晶解析では、水素原子の位 置はほとんどわからないのに対し、中性子では水素の位置を見ることができる(図:上段は中性子構造解析(水素原子が見える)、下段はX線構造解析(水素原 子はごく一部を除き見えない)。
図3.イェロープロテイン中の低障壁水素結合と短距離水素結合
今回の中性子結晶構造解析 で見出された低障壁水素結合と短距離イオン性水素結合。青が水素原子の位置。左は低障壁水素結合で、水素原子(青)がドナー(グルタミン酸46、E46の カルボン酸の酸素原子)とアクセプター(発色団p-クマール酸の酸素原子)のほぼ中央に位置している。右は短距離水素結合であるが、低障壁水素結合ではな い例(短距離イオン性水素結合)。水素原子はドナー(チロシン42,Y42の酸素原子)と共有結合している。
低障壁水素結合の新しい役割
図4.孤立した電荷の安定化
タ ンパク質内部は疎水的であり、孤立した電荷はエネルギー的に不安定なため、安定に存在できない。そのため、対イオンにより電気的に中性になっているのが一 般的である。イェロープロテインではアルギニン52が対イオンであり、これがプロトン化し、発色団の負電荷を中和していると考えられていた(上)。ところ が、R52は電気的に中性であり(プロトン化している水素原子はない)、発色団は低障壁水素結合を形成していた(下)。したがって、低障壁水素結合の高い 結合エネルギーが、孤立した電荷の不安定化を補い、また低障壁水素結合により電荷が非局在化することで、タンパク質内部に孤立した負電荷を安定化している ことが明らかになった。
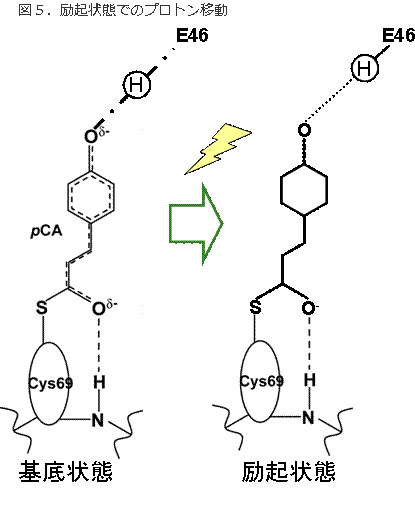
図5.励起状態でのプロトン移動
光吸収により、低障壁水素結合は通常の水素結合に緩和する。これにより、光エネルギーが発色団から蛋白質に移されたことになる。また、発色団が容易に異性化できるようになる。
【本研究に関するお問い合わせ先】
奈良先端科学技術大学院大学 物質創成科学研究科 エネルギー変換科学講座
教授 片岡幹雄(かたおか みきお) TEL 0743-72-6100 FAX 0743-72-6109
〒630-0192 奈良県生駒市高山町8916-5 E-mail kataoka@ms.naist.jp