2014/04/17
1.発表者:
熊崎 薫(東京大学大学院理学系研究科生物化学専攻博士課程2年)
千葉 志信(京都産業大学総合生命科学部准教授)
石谷 隆一郎(東京大学大学院理学系研究科生物科学専攻准教授)
塚﨑 智也(奈良先端科学技術大学院大学バイオサイエンス研究科准教授・JSTさきがけ研究者)
濡木 理(東京大学大学院理学系研究科生物科学専攻教授)
2.発表のポイント:
●タンパク質を細胞膜に組み込む「膜組み込みタンパク質YidC」の立体構造を世界で初めて決定しました。
●バクテリアから人まで共通している、タンパク質が生体膜に組み込まれる分子メカニズムを詳細に解明しました。
●本研究の成果は生命科学研究の発展に貢献するとともに、新規薬剤を開発するための基盤となりえます。
3.発表概要:
す べての生物は、細胞膜で囲まれた細胞を生命の基本単位としており、細胞膜の働きについて理解を深めることは、バクテリアから人まで共通した基本的な生命現 象を理解する上では、欠かせません。細胞膜には、タンパク質を細胞膜に組み込む働きを担っている「膜組み込みタンパク質YidC」が存在し、このタンパク 質は生命の維持に不可欠な因子です。しかし、これまでの研究においてYidCの立体構造は決定されておらず、YidCによってタンパク質が細胞膜に組み込 まれる分子メカニズムは謎でした。
東京大学大学院理学系研究科の濡木 理 教授、石谷 隆一郎 准教授、熊崎 薫 博士課程大学院生、京都産業大学総合生命科学部 千葉 志信 准教授、奈良先端科学技術大学院大学バイオサイエンス研究科 塚﨑 智也 准教授を中心とした研究グループは、世界で初めてYidCの立体構造を決定しました。そして、この詳細な構造情報に基づき研究を進めた結果、YidCは、 疎水的な(水と混ざりにくい)生体膜に親水的な(水と混ざりやすい)凹みを形成するという、予想外のユニークな構造体を形成することを発見しました。さら に、細胞膜へと組み込まれるタンパク質がYidCの親水的な溝に結合することを確かめ、YidCによってタンパク質が細胞膜に組み込まれる分子メカニズム の新しいモデルを提唱しました。
本研究は、バクテリアから人まで共通した基本的な生命現象の一つを解明し、生命科学分野の研究の発展に大きく貢献 するとともに、YidCが細菌の生育に必須なタンパク質であることから、病原菌のYidCを標的とする新規の抗生物質などの薬剤開発の基盤となることが期 待されます。本研究成果は、英国科学誌ネイチャー電子版に4月17日午前2時(日本時間)付けで公開されます。
4.発表内容:
1)研究の背景
す べての生物は、細胞膜で囲まれた細胞を生命の基本単位としています。細胞の内部にはさらに生体膜で囲まれた細胞小器官も存在し、それらの働きが生命活動を 支えています。生体膜は異なる空間を隔て、バリアーとして働くことが必要ですが、それに加えて、生命活動には生体膜を通じた適切な物質の輸送や情報の伝 達、生体膜上でのエネルギー産生などが欠かせません。これらの多様な膜機能を担うのが、疎水性の脂質二重層からなる生体膜に埋め込まれた多種多様な「膜タ ンパク質」です。そのため、膜タンパク質が生体膜へと正しく組み込まれること(タンパク質の膜組み込み)は、私たちが生きていく上で必須の機能です。 YidCは、地球上のさまざまな生物が持っている「タンパク質膜組み込み装置」であり、リボソーム(注1)で新規に合成された膜タンパク質と直接相互作用 して、それらを細胞膜に組み込みます。この過程において、膜タンパク質の親水的な膜外領域が細胞膜を通り抜けて膜の反対側へ輸送されるとともに、膜タンパ ク質の疎水的な膜貫通領域が細胞膜中にとどまる必要があります。YidCによって膜タンパク質が細胞膜に組み込まれる分子メカニズムを理解することは、基 本的な生命活動の原理を理解する上で重要な問題です。しかし、これまでYidCの立体構造は明らかとなっておらず、その分子メカニズムの詳細は謎のままで した。
2)研究内容
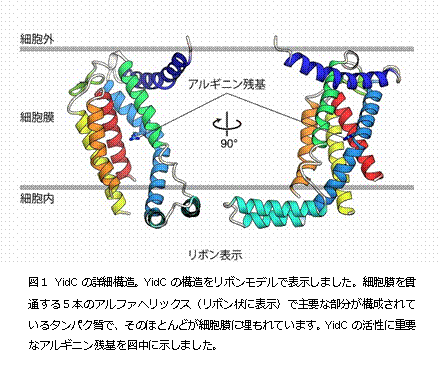
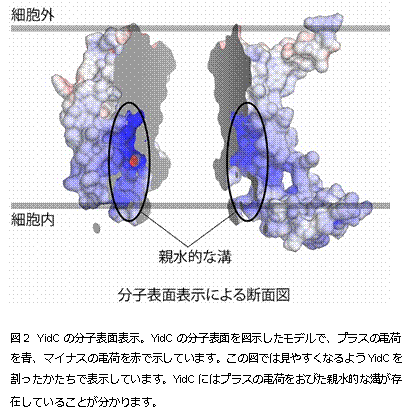
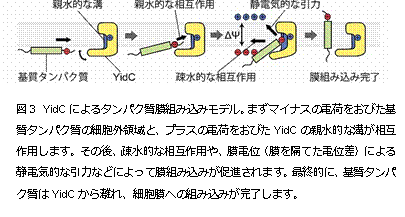
今回、本研究グループは、細菌Bacillus halodurans 由来のYidCの結晶構造を決定(注2)することに成功しました。YidCの結晶化は、脂質キュービック相(LCP)法(注3)で行い、大型放射光施設 SPring-8(注4)BL32XU(ビームライン)においてX線回折データを収集しました。その結果、2.4 Å(オングストローム、0.1ナノメートル)という高分解能でYidCの構造を解明することに成功しました(図1)。YidCの構造をみてみると、内部に 大きな溝を持っていることが分かりました。その溝は多くの親水的なアミノ酸によって構成されており、プラスの電荷を帯びていました(図2)。YidCの 「親水的な溝」が、疎水的である細胞膜の中に存在していることは、これまでの研究からは全く予測されていなかった新規の発見でした。このYidCの構造情 報に基づいて進めたin vivo クロスリンク実験(注5)や枯草菌を用いた遺伝学的解析(注6)によって、YidCは「親水的な溝」で細胞膜に組み込まれる膜タンパク質(基質タンパク 質)と相互作用することが判明しました。この溝を構成する親水的なアミノ酸のうち、溝の中心に位置するプラスの電荷を持ったアルギニン残基(72番目のア ミノ酸残基)は生物間で広く保存されており、YidCの働きに極めて重要であることを見出しました。これらの結果と過去の知見を組み合わせることで、 「YidCが基質タンパク質のうち、細胞膜に組み込まれた後に細胞外に突出する領域と親水的な溝で相互作用することで、この細胞外に突出する領域を細胞膜 の内部に引き込み膜タンパク質を生体膜へと組み込む」という新規の分子メカニズムを提唱し(図3)、タンパク質が細胞膜に組み込まれる生命現象の解明に大 きな進展が見られました。
3)研究の意義と今後の展開
本研究は、バクテリアから人まで共通した生命現象の一つである「YidCに よるタンパク質膜組み込み過程」の詳細を構造生物学的なアプローチによってはじめて解明したものです。この成果は、生体内のタンパク質の成り立ちやタンパ ク質輸送の基礎研究の発展に大きく貢献するものです。また、YidCが細菌の生育に必須なタンパク質であることから、応用研究として病原菌のYidCを標 的とした新規の抗生物質の開発等の基盤情報として利用されることが期待されます。
本研究成果は、科学技術振興機構(JST)戦略的創造研 究推進事業(さきがけ)「Secタンパク質膜透過装置の次世代構造生物学」(研究者:塚﨑智也)、科研費(20247020、 24687016、 24102503、 24121704、 24227004、 24657095、 25291006、 25291009、 25660073)、創薬等支援技術プラットフォーム、最先端研究開発支援プログラムなどの支援を受けました。
5.発表雑誌:
雑誌名:英国科学誌Nature (オンライン版に2014年4月17日午前2時(日本時間)付けで公開)
論文タイトル:Structural basis of Sec-independent membrane protein insertion by YidC
著 者:熊崎 薫*、千葉 志信*、武本 瑞貴、古川 新、西山 賢一、菅野 泰功、森 貴治、堂前 直、平田 邦生、名倉 淑子、マツラナ アンドレス、田中 良樹、森 博幸、杉田 有治、有坂 文雄、伊藤 維昭、石谷 隆一郎、塚﨑 智也**、濡木 理**(*同等貢献、**責任著者)
DOI番号: 10.1038/nature13167
6.注意事項:日本時間4月17日(木)午前2時 (イギリス時間:16日(水)午後6時)以前の公表は禁じられています。
7.用語解説:
(注1)リボソーム:遺伝子の情報に基づいて、生体内でタンパク質を合成する装置である。その重要性から古くから研究がなされ、2009年には「リボソームの機能と構造解析」にノーベル化学賞が授与されている。
(注2)結晶構造を決定:本研究ではX線結晶構造解析法を用い、タンパク質の立体構造を明らかとした。X線結晶構造解析では、目的物質の結晶にX線を照射し、反射データ収集し、解析することにより構造決定を行う。
(注3)脂質キュービック相(LCP)法:タンパク質を脂質二重層に再構成させた状態で結晶化させる方法で、近年、膜タンパク質の結晶構造決定の例が多く報告されている。
(注4)SPring-8:兵庫県佐用町に位置する世界最大級の大型放射光施設。強いX線を用いた実験が可能である。
(注5)in vivo クロスリンク実験:生体内でタンパク質を架橋させることでタンパク質間の相互作用を検出する方法の一つ。本研究では細胞膜に組み込まれるタンパク質と相互作用するYidCの部位を同定した。
(注 6)枯草菌を用いた遺伝学的解析:本研究では枯草菌染色体のyidC遺伝子を改変することで、YidCの活性を菌体の色で判別できるようにした枯草菌を作 製した。この枯草菌を用いることにより、YidCを構成するアミノ酸残基の一部を改変させたYidCの活性を系統的に調べた。
【関連リンク】
・論文は以下に掲載されております。
http://dx.doi.org/10.1038/nature13167
http://library.naist.jp/dspace/handle/10061/9244
(NAIST Academic Repository:naistar)
・以下は論文の書誌情報です。
Kaoru Kumazaki, Shinobu Chiba, Mizuki Takemoto, Arata Furukawa, Ken-ichi Nishiyama, Yasunori Sugano, Takaharu Mori, Naoshi Dohmae, Kunio Hirata, Yoshiko Nakada-Nakura, Andrés D. Maturana, Yoshiki Tanaka, Hiroyuki Mori, Yuji Sugita, Fumio Arisaka, Koreaki Ito, Ryuichiro Ishitani, Tomoya Tsukazaki & Osamu Nureki
Structural basis of Sec-independent membrane protein insertion by YidC
Nature 509, 516-520 (22 May 2014)