2018/02/27
力と分子の滑りを利用した神経ネットワーク形成の新しい仕組みを解明
~ ヒトの脳疾患の分子病態も明らかに ~
【概要】
奈良先端科学技術大学院大学(奈良先端大、学長:横矢 直和)バイオサイエンス研究科の稲垣直之教授、箱嶋敏雄教授、独立行政法人国立病院機構大阪医療センター 臨床研究センターの金村米博部長、東京大学大学院 工学系研究科の渡邉力也講師らのグループは、神経細胞と細胞外の異なる環境との間に生じる力と、それを弱める分子の滑りを巧妙に利用して進行方向などを調節するという神経ネットワーク形成の新しい仕組みを解明した。また、この仕組みが働かなくなると、神経ネットワークの形成障害や精神発達遅滞、失語症、歩行障害等の症状を伴う「L1症候群」という病気を引き起こすことも突き止めた。
脳内の神経細胞は、軸索と呼ばれる長い突起を適切な場所に伸ばして、適切な神経細胞と結合することで脳の活動に必要な情報ネットワークを作る。その方法の一つとして、軸索の先端が伸びて、道路に相当する細胞外基質上を走り、そこにある化学標識に直接触れて探索しながら正しい進行方向を決定することが知られている。しかし、軸索の先端がどのようにして道路上の化学標識を検知して進行方向を決めるのか、その仕組みはよくわかっていなかった。稲垣教授らは、「L1-CAM」という軸索先端を動かすタイヤの役割の分子が路面上の化学標識をとらえて推進力を生み出したり、路面とスリップを起こして推進力を弱めたりして進行方向や速度を決める仕組みを解明した。また、L1症候群ではL1-CAMに変異が起こるが、変異したL1-CAMではこの仕組みに障害が生じて、軸索が正しい方向に伸びることができないことも証明した。
本研究の成果により神経ネットワーク形成やヒトの脳疾患についての理解が深まるとともに、再生医療への応用などが期待できる。この研究成果は平成30年2月26日(現地時間)付けで米国科学アカデミー紀要のオンライン版に掲載される(プレス解禁日時:日本時間 平成30年2月27日(火)午前5時)。
【解説】
成果のポイント
- 力と分子の滑りを巧妙に利用して神経軸索を適切な場所に伸ばす仕組みを解明
- 精神発達遅滞、失語症等、歩行障害等の症状を伴うL1症候群の分子病態解明に成功
- 軸索伸長や細胞移動の方向を調節するための新しい分子機構を提唱
研究の背景
脳内の神経細胞は、軸索と呼ばれる長い突起を適切な場所に伸ばして、別の神経細胞とうまく結合することで脳の活動に必要な情報ネットワークを作る。その方法の一つとして、軸索の先端が道路に相当する細胞外基質上の化学標識に直接触れて、探索しながら正しい進行方向を決定することが知られており、走触性(haptotaxis)と呼ばれている。しかし、軸索の先端がどのようにして細胞外基質上の化学標識を検知して進行方向を決定するのか、その仕組みはよくわかっていなかった。研究グループは、これまでに、「L1-CAM」という細胞膜上に存在するタンパク質が軸索を伸ばすための推進力を伝えるタイヤのような働きをすることを見出していた。そこで今回は、L1-CAMの走触性への関与を調べた。
研究の手法
実験では、ラット脳内の海馬という組織にある神経細胞を培養し、材料として使用した。神経細胞は、化学標識としてラミニンとポリリジンという物質のマイクロパターンをコーティングした細胞外基質上に培養した。神経細胞はラミニン上にもポリリジン上にも軸索を伸ばすことができる。しかし、化学標識としてはポリリジンよりラミニンを好むため、基質上を探索しながらラミニンに沿って伸びていく(走触性)。本研究において軸索先端上のL1-CAMの動きを、高感度顕微鏡カメラと全反射顕微鏡を用いてライブ計測した。さらに、軸索の先端で発生する微細な駆動力の測定のために、神経細胞を複数の蛍光ナノビーズ(ゲルの変形をモニターする粒子)を包埋したゲルの上に培養し、力の発生に伴うゲルの歪みをビーズの動きから計測した。発生した駆動力の大きさと方向は、計測したビーズの動きをコンピュータで解析して求めた。
結果
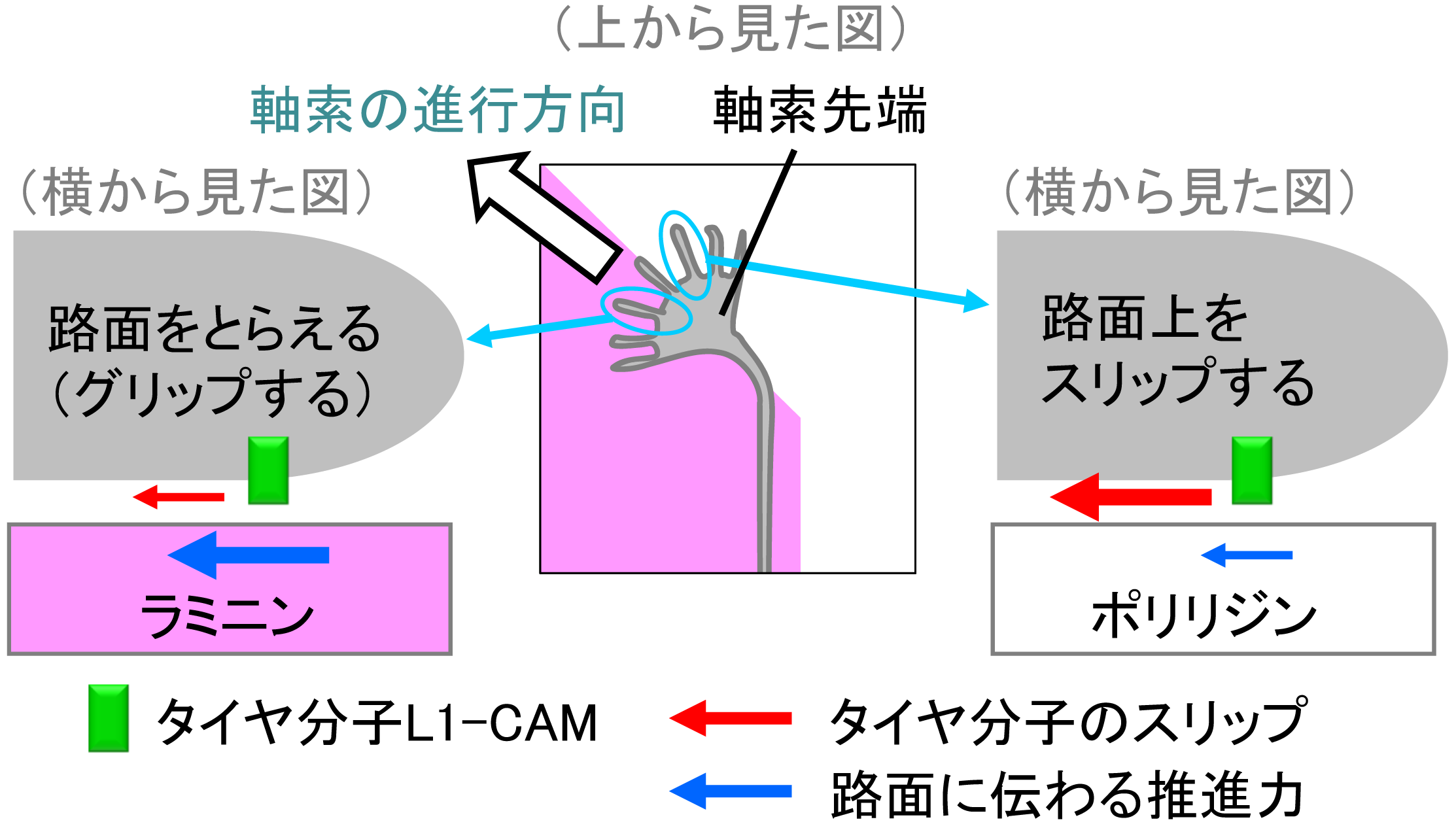
神経細胞をラミニンとポリリジンのマイクロパターン上に培養すると、ラミニンに沿って軸索を延ばした。しかし、L1-CAMを働けなくすると、軸索をラミニンに沿って伸ばすことができなくなった。この結果から、L1-CAMがラミニンに向かう軸索の走触性に必要とされることがわかった。また、軸索の先端では、タイヤにあたるL1-CAMがラミニン上では路面をとらえて(グリップして)推進力を効率的に生み出す。一方、ポリリジン上ではスリップして推進力が効率的に路面に伝わらないことがわかった。以上の結果から、軸索先端がL1-CAMと路面とのグリップとスリップを巧妙に利用して正しい方向に進んでゆくことが明らかとなった(補足図)。さらに、L1症候群の患者由来のL1-CAMの一つでは、グリップとスリップの仕組みに障害が生じて、軸索が正しい方向に伸びることができないことも証明した。
研究の意義と位置づけ
「軸索の先端がいかに細胞外基質上の化学標識を検知して進行方向を決定するのか」という走触性の仕組みは不明であったが、今回の発見は、その仕組みを分子と力のレベルで明らかにした点に意義がある。また、これまでに走触性のモデルとして、軸索先端の細胞内でおこる化学反応が重要な役割を果たすと提唱されていたが、本研究により、細胞と細胞外環境の間に生じる力と分子の滑りを巧妙に利用した新しい仕組みが明らかとなった(補足図)。軸索を適切な場所に伸ばす分子の仕組みの解明は、神経再生の治療法開発にとって基盤となる知見である。また、このような力の発生の仕組みは、免疫細胞の移動やがん細胞の浸潤など他の細胞にも存在する可能性が指摘されており、神経科学に加えて免疫学やがん研究といった医学領域の研究の加速も期待できる。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣 直之)および日本学術振興会(JSPS)科学研究費、大阪難病研究財団、武田科学財団による支援によって実施した。
【用語説明】
- 軸索:神経細胞から伸びる長い突起。他の神経細胞と結合することで脳の活動に必要な情報ネットワークを作る。神経細胞のシグナルは、軸索を通して他の細胞に伝えられる。発生時期の神経ネットワーク形成の過程では、軸索の先端が外部環境を探索しながら正しい方向へと進んでゆく。
- L1-CAM:細胞膜に存在する細胞接着分子。細胞と細胞外基質や他の細胞とを接着する働きがある。神経細胞では、L1-CAMが軸索の伸長に重要な役割を果たすことが知られている。
- マイクロパターン:本実験のラミニンとポリリジンのマイクロパターンの作成法として、ガラスをポリリジンでコートし、その上に幅14マイクロメートルのラミニンでコートされた道筋を作った。
- L1症候群: L1症候群は、L1-CAM遺伝子の変異によって発症する神経難病の総称。1949年にBickersとAdamsによって報告された水頭症、精神発達遅滞、下肢の痙性麻痺、拇指の内転屈曲を臨床的特徴とする「X連鎖性劣性遺伝性水頭症(X-linked hydrocephalus:XLH)」を代表とし、水頭症を併発しない「MASA症候群」、「伴性劣性痙性麻痺(X-linked Spastic Paraplegia Type 1)」、および「伴性劣性脳梁欠損症(X-linked corpus callosum agenesis)」などの疾患が含まれる。現在までに、上述した4種の神経難病において少なくとも全世界で250家系以上にL1-CAM遺伝子変異が同定されており、中でもXLH においてはL1-CAM遺伝子変異は、最も頻度の高い遺伝子変異である。国内のXLHでは既に100家系以上の変異が確認されており、小児神経難病の一つであるXLHの遺伝子診断と分子病態解明の上で最も重要な遺伝子変異の一つである。
【掲載論文】
(1) Title : Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis
(2) naistar:http://library.naist.jp/dspace/handle/10061/12210(NAIST Academic Repository:naistar)
【問い合わせ先】
<研究に関すること>
国立大学法人 奈良先端科学技術大学院大学 バイオサイエンス研究科 神経システム生物学研究室
教授 稲垣 直之
電話番号:0743-72-5466
E-mail:ninagaki@bs.naist.jp
<報道に関すること>
国立大学法人 奈良先端科学技術大学院大学 企画総務課 広報渉外係
電話番号:0743-72-5026
E-mail:s-kikaku@ad.naist.jp
<事業に関すること>
国立研究開発法人 日本医療研究開発機構(AMED) 基盤研究事業部 研究企画課
電話番号:03-6870-2224






