2018/03/02
酵母による必須アミノ酸「バリン」の高生産に成功
合成酵母の制御機構を解除して実現
~バイオ燃料「イソブタノール」生産にも期待~
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)バイオサイエンス研究科ストレス微生物科学研究室の高木博史教授の研究グループは、哺乳類の必須アミノ酸であり、筋肉強化や肝機能改善などの効果が知られているバリンを酵母の細胞内で高効率に生産させることに成功しました。
酵母※1は発酵産業において広く利用されている微生物ですが、アミノ酸の生産に活用した例は未だ多くはありません。しかしながら、酵母を用いて製造される発酵食品や飼料等に含まれるアミノ酸の量を直接高めることができれば、製品の高付加価値化や発酵産業上有用な技術の確立に貢献できると考えられます。また、炭素分子が枝分かれした構造のアミノ酸(分岐鎖アミノ酸※2)の一種であるバリンは、飼料やサプリメント、抗ウィルス薬の原料などに広く用いられ、主に大腸菌やコリネバクテリウム属の細菌を用いた発酵法により生産されていますが、食品として高い安全性が認められている酵母を使えれば、有用性の高い技術になることが期待されます。
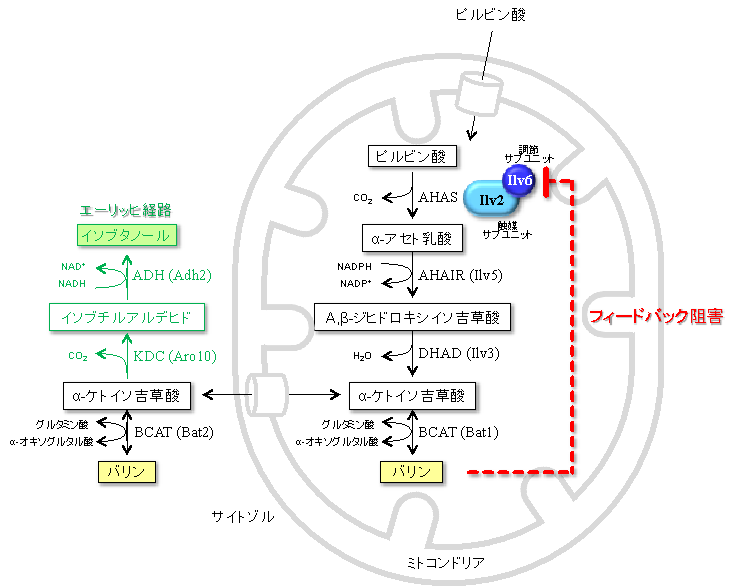
本研究では、酵母において未解明だったバリンの合成を制御する機構について調べるため、特に、その機構で重要な役割を担う「アセトヒドロキシ酸合成酵素(AHAS)」という酵素に着目しました。その結果、AHASを構成するタンパク質(サブユニット)のうち、酵素反応の調節を担当するIlv6というタンパク質のアミノ酸の一部を他のアミノ酸に置換すると、その改変酵素を発現する酵母の細胞内ではバリン含量が約4倍に増加することを見出しました。通常、細胞内で合成されたバリンはAHASをフィードバック阻害※3することで過剰生産を防いでいますが、その仕組みが解除されたのです。
一方で、他の分岐鎖アミノ酸(ロイシン、イソロイシン)の含量には影響を及ぼさなかったことから、酵母における分岐鎖アミノ酸の合成経路は共通であるものの、合成制御機構は各アミノ酸で独立している可能性が示されました。
また、大腸菌ではフィードバック阻害を解除したアミノ酸置換が、酵母ではまったくバリン合成に影響を及ぼさなかったことから、原核生物(大腸菌)と真核生物(酵母)における酵素機能の違いも明らかになりました。
本研究で得られた知見は、酵母を用いたバリンの発酵生産や、真核生物におけるバリン合成の制御メカニズムの理解につながる有用なものであると考えられます。また、本研究の成果はバリンから合成され、バイオ燃料として期待されているイソブタノールの生産にも応用できる可能性があります。
この研究成果は、国際代謝工学会の学会誌であるMetabolic Engineering誌オンラインサイトに平成30年2月22日付けで掲載されました。
【解説】
研究背景
近年、アミノ酸は細胞内や血漿などに遊離した形で存在し、生体内で重要な役割を果たしていることから、その生理機能が注目されており、様々な食品、飲料、化粧品に添加されています。例えば、バリンをはじめ、ロイシン、イソロイシンといった分岐鎖アミノ酸は代表的な必須アミノ酸で、筋肉強化、肝機能改善、疲労回復などの効果があることが知られています。バリンは、飼料やサプリメント、抗ウィルス薬の原料などに広く用いられ、主に大腸菌やコリネバクテリウム属の細菌を用いた発酵法により生産されています。酵母のSaccharomyces cerevisiae(サッカロミセス・セレビシエ)は醤油、酒類、パン類などの発酵・醸造食品、バイオエタノールなどの製造に使用され、8兆円超と想定される巨大産業を支えている重要な微生物です。従って、食品として高い安全性が認められている酵母を用いてバリンを発酵生産することができれば、有用性の高い技術になることが期待されます。
また、真核生物のモデルとしても知られる酵母におけるバリンの合成制御機構と生理的役割の解明は、高等生物における研究にも貢献すると考えられます。そこで本研究では、バリン合成を制御している鍵酵素であるアセトヒドロキシ酸合成酵素(AHAS)に着目し、酵母での機能解析を行いました。
研究結果
大腸菌をはじめとする多くの細菌では、AHASがバリンによりフィードバック阻害を受けることから、バリンの合成量を調節している鍵酵素であることが知られています。一方、酵母のAHASは触媒サブユニットのIlv2タンパク質および調節サブユニットのIlv6タンパク質から構成され(図1)、Ilv6タンパク質にバリンが結合することによりAHASの活性が阻害されると推測されています。
本研究では、大腸菌のAHASにおいてフィードバック阻害を解除するアミノ酸置換の例を参考にして、酵母のIlv6タンパク質に同様のアミノ酸置換を導入し、AHAS活性に及ぼす影響を解析しました。その結果、バリンとの結合部位を有する領域内の86番目残基(アスパラギン), 89番目残基(グリシン), 104番目残基(アスパラギン)に対し、それぞれアラニン、アスパラギン酸、ヒスチジンに置換したIlv6変異体(Asn86Ala, Gly89Asp, Asn104His)を発現する酵母では、バリンのアナログ※4(構造が類似した化合物)であるノルバリンに対する耐性が野生型株よりも上昇し、細胞内のバリン含量が約4倍に増加しました(図2)。一方で、他の分岐鎖アミノ酸の含量には影響を及ぼさなかったことから、酵母における分岐鎖アミノ酸の合成経路は共通であるにも関わらず、合成制御機構は各アミノ酸で独立している可能性が示されました。
さらに、酵母のIlv2およびIlv6を組換えタンパク質として調製し、試験管内での再構成系を用いてAHAS活性を測定したところ、Asn86Ala, Gly89Asp, Asn104His置換がバリンによるフィードバック阻害を解除することが明らかになりました(図3)。以上の結果から、AHASのフィードバック阻害機構が生物間で広く保存されていることが示されました。また、大腸菌ではフィードバック阻害を解除したアミノ酸置換が、酵母ではバリン合成量に全く影響を及ぼさなかったことから、原核生物(大腸菌)と真核生物(酵母)における酵素機能の違いも明らかになりました。
研究意義
今回の研究により、酵母のAHASにおける調節サブユニットIlv6にアミノ酸置換を導入することで、バリンによるAHASのフィードバック阻害が解除され、それらのアミノ酸置換体を発現する酵母では細胞内のバリン含量が著しく増加することに初めて成功しました。また、AHASのフィードバック阻害が解除されたIlv6変異体を発現する酵母ではバリンのアナログであるノルバリンに対する耐性が上昇していたことから、「ノルバリン耐性」の有無がバリン高生産株の選抜・育種の指標になることが分かりました。今回の研究で得られた知見は、酵母を用いたバリンの発酵生産技術や、真核生物におけるバリン合成の制御メカニズムの理解につながるものであると考えられます。また、本研究の成果はバリンから合成され、バイオ燃料として期待されているイソブタノールというアルコールの生産にも応用できる可能性があります。
さらに、酵母を用いたアミノ酸の高生産に関する知見と技術は、様々な発酵・醸造食品(酒類、パン類、醤油、味噌、酵母エキスなど)の製造にとどまらず、バイオエタノールを含む主要な酵母利用産業の高度化・効率化に役立つ技術への展開も期待されます。
【解説図】
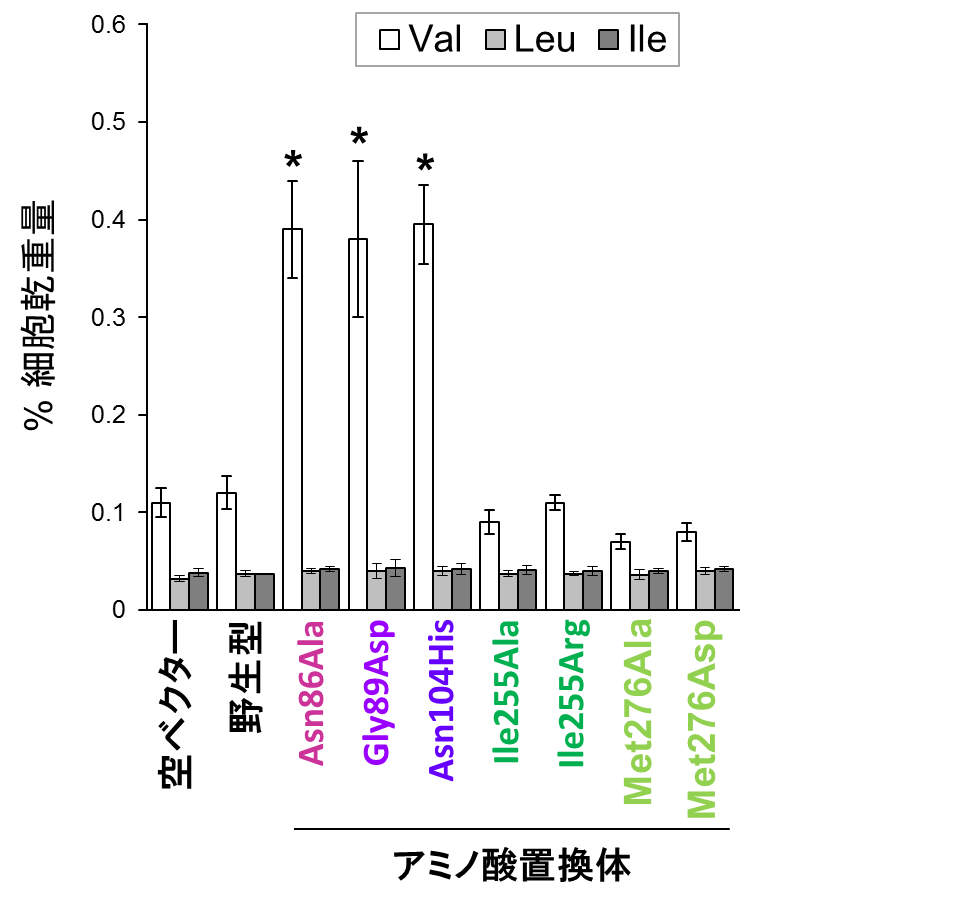
(Val:バリン、Leu:ロイシン、Ile:イソロイシン)
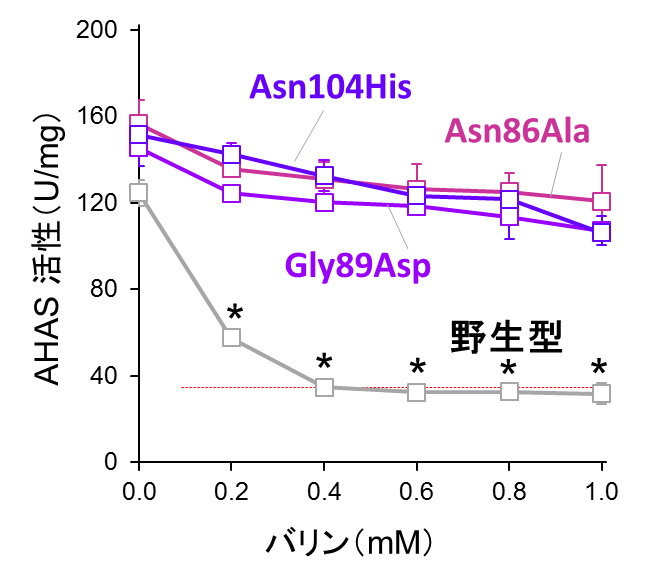
(赤線はIlv2タンパク質のみのAHAS活性)
【掲載論文】
タイトル:High-level production of valine by expression of the feedback inhibition-insensitive acetohydroxyacid synthase in Saccharomyces cerevisiae
(和訳:酵母におけるフィードバック阻害非感受性型アセトヒドロキシ酸合成酵素の発現によるバリン高生産)
著者:Natthaporn Takpho, Daisuke Watanabe, Hiroshi Takagi
所属:奈良先端科学技術大学院大学
掲載誌:Metabolic Engineering
naister:http://hdl.handle.net/10061/12216 (NAIST Academic Repository:naistar)
【用語解説】
※1:酵母
酵母のうち基礎研究のモデル株を実験室酵母という。実験室酵母では遺伝解析やゲノム解析による知見が蓄積され、遺伝子操作技術も確立しているが、発酵力は弱く発酵食品などの生産には不適である。一方、製パン・醸造、バイオエタノール生産などに用いられる菌株を産業酵母といい、発酵性や生育速度の優れた株が選択されているが、遺伝特性や倍数性が異なり、実験室酵母の知見や技術が活用されていない。本研究では、実験室酵母を使用した。
※2:分岐鎖アミノ酸
側鎖の炭素鎖が枝分かれしたロイシン、イソロイシン、バリンの総称でいずれも必須アミノ酸である。筋肉タンパク質の合成促進と分解抑制の両方の作用があり、運動時のエネルギー源として利用される。特に、バリンには筋肉修復や肝機能改善、美肌促進などの効果も報告されている。バリンを多く含む食材としては、レバー、子牛肉、脱脂粉乳、プロセスチーズ、落花生などが知られている。
※3:フィードバック阻害
代謝経路の最終産物(本研究ではバリン)が初発反応の酵素(本研究ではアセトヒドロキシ酸合成酵素)に結合し、その酵素の活性を阻害すること。野生型の細胞では、この仕組みによって最終産物が過剰に合成されないように厳密に調節されている。初発反応の酵素を遺伝的に改変し、フィードバック阻害を解除することで、最終産物の過剰合成(高生産)が可能になる。
※4:アナログ
アナログとはアミノ酸と構造や性質が類似している化合物のことを言う。細胞内で対応するアミノ酸と競合してタンパク質に取り込まれ、構造や機能が損なわれたタンパク質を生成することで、生育阻害・細胞死を引き起こすものもある。その場合、アナログを含む培地で生育できる株(耐性株)を分離すると、対応するアミノ酸を細胞内外に著量生産していることが多い。本研究ではバリンの高生産株を取得するため、バリンのアナログであるノルバリンを使用した。
【本研究内容についてコメント出来る方】
乾 将行[(公財)地球環境産業技術研究機構 バイオ研究グループ グループリーダー 主席研究員]
TEL: 0774-75-2308 FAX: 0774-75-2321 E-mail: inui@rite.or.jp
【お問い合わせ先】
奈良先端科学技術大学院大学 バイオサイエンス研究科
総合システム生物学領域 ストレス微生物科学研究室 教授 高木 博史
TEL: 0743-72-5420 FAX: 0743-72-5429 E-mail: hiro@bs.naist.jp






