2018/08/07
神経軸索が正しい方向に伸びる仕組みを解明
~進路決定のための高感度ナビゲーターが明らかに~
脳疾患の解明や再生医療への応用に期待
【概要】
奈良先端科学技術大学院大学(奈良先端大、学長:横矢 直和)先端科学技術研究科 バイオサイエンス領域の馬場健太郎研究員、稲垣直之教授、同大 研究推進機構の河野憲二特任教授、カリフォルニア大学デービス校のJames S. Trimmer(ジェイムズ・トリマー)教授、東京大学大学院 工学系研究科の渡邉力也講師らのグループは、神経細胞が細胞外の超微細な誘引シグナルの違いを高感度に感知して軸索が伸びる方向を決定するためのナビゲーター分子を発見し、その働きを明らかにしました。また、この進路決定のためのナビゲーター分子が働かなくなると、軸索が方向転換をすることができなくなり、脳内の情報ネットワークに異常が生じることも突き止めました。
脳内の神経細胞は、軸索と呼ばれる長い突起を脳内の正しい場所に伸ばして、正しい神経細胞と結合することで脳の活動に必要な情報ネットワークを作ります。その方法の一つとして、軸索の先端がまわりの誘引分子を検知し、分子が多く存在する方向に向かって伸びることが知られており、走化性と呼ばれています。しかし、その仕組みはよくわかっていませんでした。稲垣教授らは、軸索が周囲に存在するネトリンという誘引分子のわずかな濃度差を検知してシューティンという軸索を伸ばす役割のタンパク質に伝えることにより、ネトリンが多く存在する方向に軸索伸長を誘導するという仕組みを解明しました。また、この仕組みが働かなくなるマウスを作製したところ、軸索が伸びる方向を決められず、脳内の軸索の走行経路に異常が生じることもわかりました。
本研究の成果により神経ネットワーク形成やヒトの脳疾患についての理解が深まるとともに、再生医療への応用などが期待できます。この研究成果は日本時間平成30年8月7日(火)に英国の学術誌eLifeに掲載されます。
【解説】
研究の背景
脳内の神経細胞は、軸索(用語説明1)と呼ばれる長い突起を脳内の正しい場所に伸ばして、正しい神経細胞と結合することで脳の活動に必要な情報ネットワークを作ります。その方法の一つとして、軸索の先端が細胞の外の誘引分子(用語説明2)を検知して、誘引分子が多い方向に向かって伸びることが知られており、走化性(用語説明3)と呼ばれています。この軸索の走化性の概念は、100年以上前(1890年)にノーベル賞科学者のラモン・イ・カハールによって想定され、その後の研究で実際に起こることが検証されたものの、軸索のナビゲーションの仕組みはよくわかっていませんでした。研究グループは、これまでの研究で、「シューティン」(用語説明4)という分子が、「ネトリン」(用語説明5)と呼ばれる細胞外の誘引分子に反応して、軸索内で活性化されて軸索を伸ばすためのための力を生み出すことを見出していました(Toriyama et al., Curr. Biol., 2013; Kubo et al., J. Cell Biol., 2015)。そこで今回は、シューティンがネトリンによる軸索のナビゲーション(走化性)のために軸索の進行方向を決定することができるのかを調べました。
研究の手法
実験では、マウスやラット脳内の海馬(用語説明6)という組織にある神経細胞を培養し、材料として使用した。また、マイクロ流路(マイクロメートルサイズの流路)を用いて細胞外に誘引分子ネトリンの超微細な濃度勾配を作成しました。軸索の先端で活性化するシューティンを可視化するために活性型のシューティンにだけ結合する抗体を用いてラベルしました。シューティンの走化性への関与を調べるために、シューティンの活性が調節できない変異体(常に活性化している恒常活性型のシューティン)を作製して神経細胞に導入し、軸索の伸びる方向を調べました。また、脳内におけるシューティンの働きを調べるためにシューティンノックアウトマウスを作製して軸索の走行を解析しました。
結果
マイクロ流路を用いて培養液にネトリン分子の濃度勾配を作成し、神経細胞の軸索先端を刺激したところ、軸索がネトリン分子の僅かな濃度の差(250:251の差)を高感度に検知してネトリンの多い方向に向かって伸びることがわかりました。また、この僅かなネトリンの濃度差に反応して、軸索先端内においてネトリンの多い側にシューティンの強い活性化が観察されました(図1A)。シューティンの活性化をブロックすると軸索先端での進路決定のための力の発生が抑制され、さらに、ネトリンに向かったシューティンの活性化を途中でできなくすると、軸索がネトリンに向かって進路決定をすることができなくなりました(図1B)。また、シューティンノックアウトマウスでは脳内の軸索のネットワーク形成に異常が生じることも証明しました(図2)。以上の結果から、シューティンが僅かなネトリンの濃度差に反応して軸索の伸長方向を決定するための高感度ナビゲーターとして働くことがわかりました。
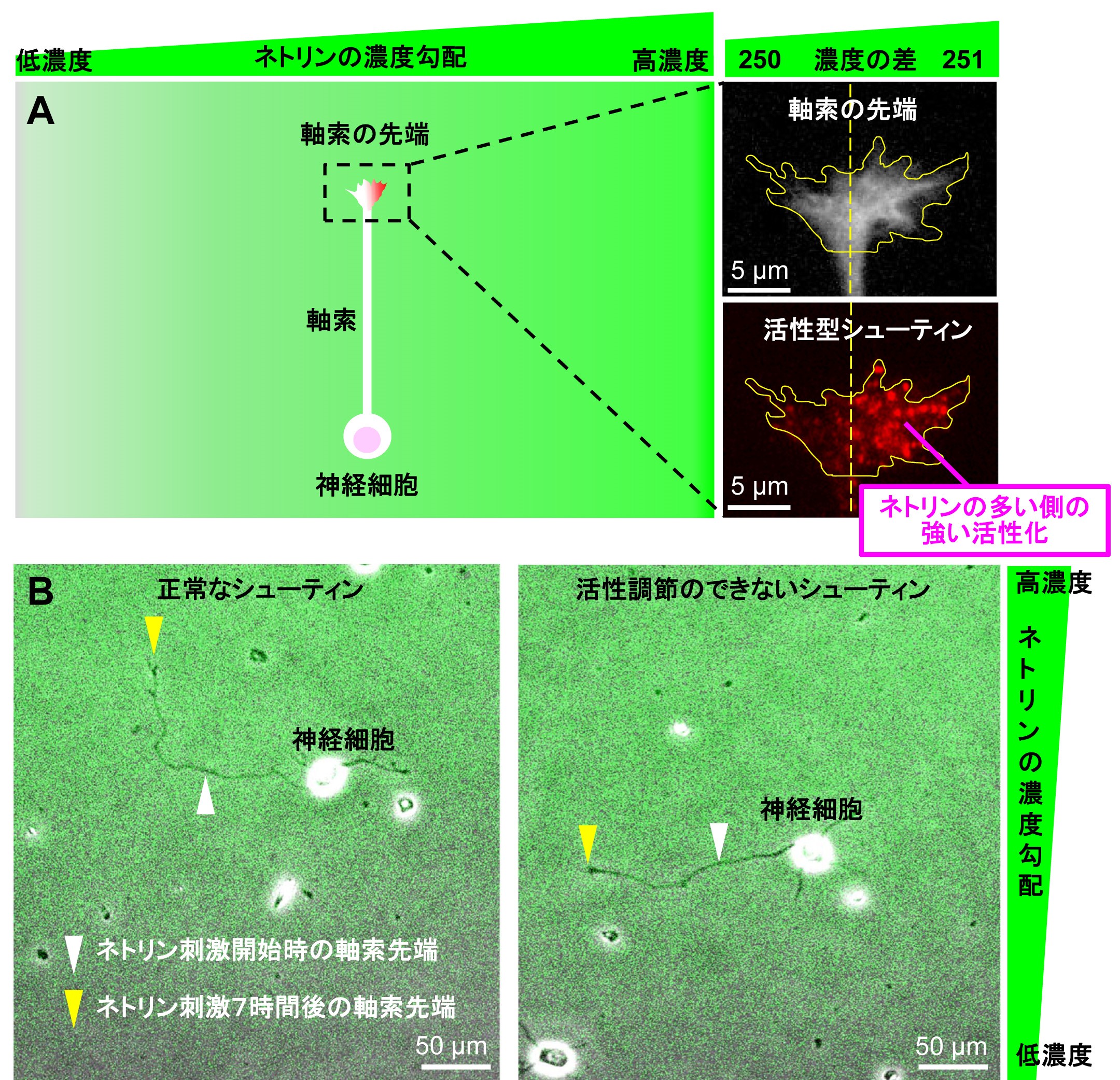
A. 軸索がネトリン分子の僅かな濃度の差(250:251の差)を高感度に検知して,軸索先端内においてネトリンの多い側にシューティンの強い活性化が起こる。活性型シューティンは、活性型シューティンに結合する抗体を用いてラベルした
B. シューティンが正常に働くと、軸索がネトリン分子の僅かな濃度の差を検知してネトリンの多い方向に向かって方向転換する(左)。一方、常に活性化している恒常活性型のシューティンを用いてネトリンの多い方向に偏ったシューティンの活性化をできなくすると、軸索は伸びるがネトリンに向かって進路決定をすることができなくなる(右)。
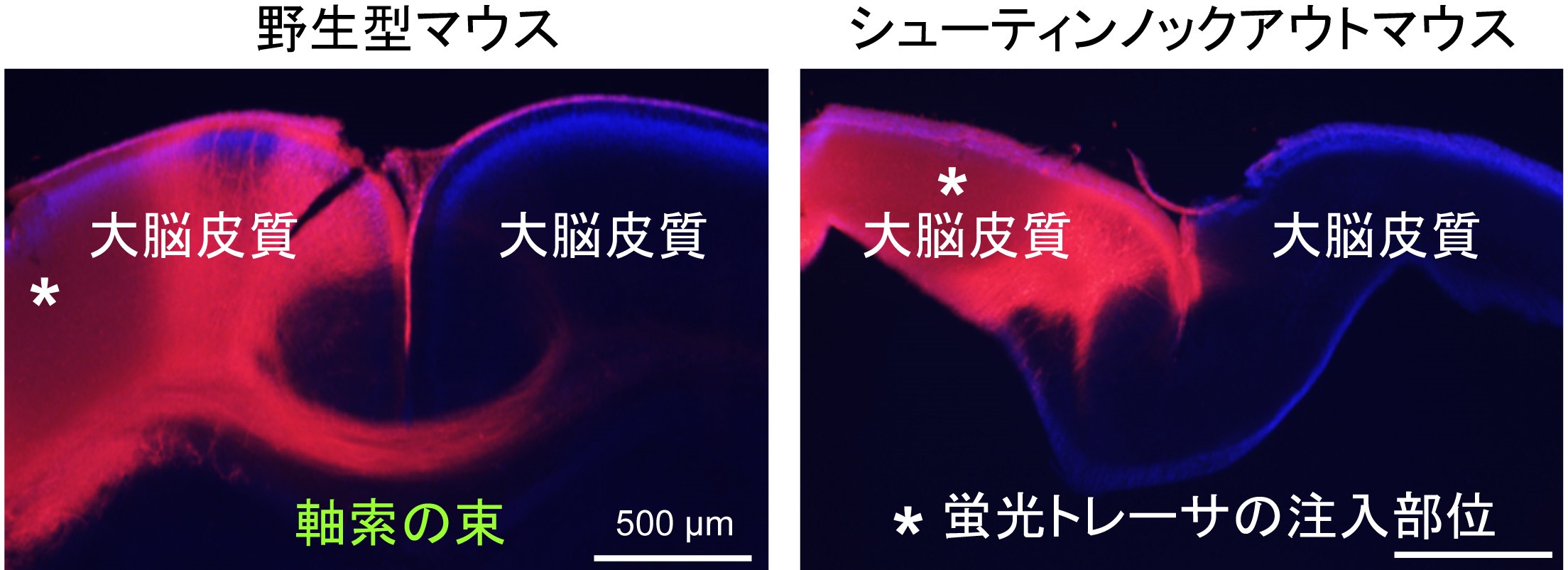
マウスの左右の大脳皮質をつなぐ軸索の束を蛍光トレーサ―でラベルした(赤色)。野生型のマウスでは軸索の束が反対側の大脳皮質に伸びているが(左)、
シューティンノックアウトマウスでは軸索が反対側の大脳皮質に向かって伸びていない(右)。
研究の意義と位置づけ
これまでに、軸索先端が誘引分子の僅かな濃度差を検知して進行方向を決定することが知られていましたが、本研究により、その中心となる仕組みの一端が明らかとなりました。特に、ネトリンのごく僅かな濃度差が軸索内のシューティンによって検知され、その方向性を持った活性化が進路決定のための力を生み出すことから、シューティンが軸索の進路決定のための高感度ナビゲーターとして働くことが解明された点に意義があります。今回の軸索進路決定のナビゲーターの解明は、神経再生の治療法開発にとって基盤となる知見と考えられます。走化性は、神経回路形成、免疫反応、創傷治癒、再生等に重要な役割を果たします。また、走化性の障害は、奇形や神経障害、免疫不全、がんの転移等の病態に関与します。また、このような走化性の仕組みは、免疫細胞の移動やがん細胞の浸潤など他の細胞にも存在する可能性が指摘されており、神経科学に加えて免疫学やがん研究といった医学領域の研究の加速も期待できます。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」研究開発領域における研究開発課題「細胞-基質間の力を基盤とした細胞移動と神経回路形成機構の解明およびその破綻による病態の解明」(研究開発代表者:稲垣 直之)および日本学術振興会(JSPS)科学研究費、大阪難病研究財団、武田科学財団による支援によって実施しました。
【用語説明】
- 軸索
神経細胞から伸びる長い突起。他の神経細胞と結合することで脳の活動に必要な情報ネットワークを作る。神経細胞のシグナルは、軸索を通して他の細胞に伝えられる。発生時期の神経ネットワーク形成の過程では、脳内で軸索の先端が細胞外のシグナルに誘導されて正しい方向へと進んでゆく。 - 誘引分子
神経軸索を誘引して伸びる方向を調節し、軸索を標的細胞付近まで正しく誘導するための信号となる分子 - 走化性
細胞や軸索先端が、細胞外の誘引・反発分子の濃度勾配に反応して濃度の濃い方向あるいは薄い方向に移動すること。脊椎動物では、胚発生や組織形成、神経回路形成、免疫反応、創傷治癒、再生等に重要な役割を果たす。また、走化性の障害は、奇形や神経障害、免疫不全、がんの転移等の病態に関与する。 - シューティン
神経軸索を伸ばす細胞内分子。軸索の先端で軸索を伸ばすための力の形成に関与する。最近、神経細胞以外の細胞にもシューティンが存在することが報告された。 - ネトリン
神経軸索を誘引する分子の一つ。軸索の誘引のみならず乳腺や肺、血管の形成にも関与することが知られている。 - 海馬
大脳組織の一部で記憶や学習に関わることが知られている。
【掲載論文】
naister:http://hdl.handle.net/10061/12561(NAIST Academic Repository:naistar)
【本プレスリリースに関するお問い合わせ先】
<研究に関すること>
奈良先端科学技術大学院大学 バイオサイエンス研究科 神経システム生物学研究室
教授 稲垣 直之
TEL:0743-72-5466
E-mail: ninagaki@bs.naist.jp
<報道に関する事>
奈良先端科学技術大学院大学 企画総務課 広報渉外係
TEL: 0743-72-5026 FAX: 0743-72-5011
E-mail: s-kikaku@ad.naist.jp
【AMED事業に関するお問い合わせ先】
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask@amed.go.jp
/cgi-bin/apps/mt.cgi?__mode=view&_type=entry&blog_id=6&id=5185






