2019/08/13
水素の分解・合成酵素の水素イオンの輸送経路の特定に成功
~燃料電池のエネルギー源や水素を添加する化合物の生産への利用に期待~
【概要】
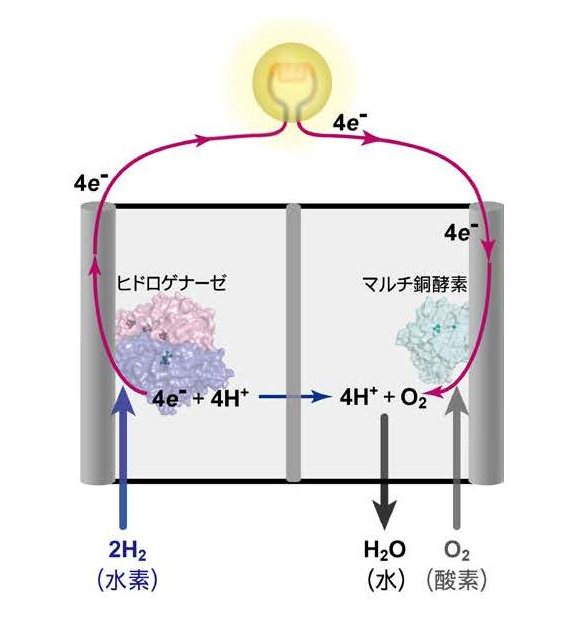
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科 物質創成科学領域の超分子集合体科学研究室 廣田俊教授、太虎林特任助教(現:中国中山大学特聘副研究員)の研究グループと、兵庫県立大学(学長:太田勲)生命理学研究科の樋口芳樹教授、及び中山大学(学長:羅俊)の毛宗万教授の共同研究グループは、水素エネルギーの利用に不可欠な水素分子を分解したり、合成したりする反応(図1)を高効率で可逆的に触媒する酵素(ニッケル-鉄ヒドロゲナーゼ、図2、3、4)について、触媒反応のキーポイントとなる水素イオン輸送のメカニズムを初めて明らかにした。この酵素に含まれるニッケル原子に結合したシステインというアミノ酸の残基や、その近傍のグルタミン酸(アミノ酸)の残基、さらに酵素内部に固定化された水分子の3つが協同して水素イオンの輸送を行っていた。(図5)。この酵素による触媒反応の効率は、現在の燃料電池に使われている白金等の希少金属触媒を上回る。今回の成果は、新たな方式の燃料電池や水素合成触媒の開発につながる研究と期待されている。
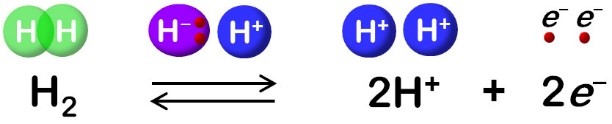
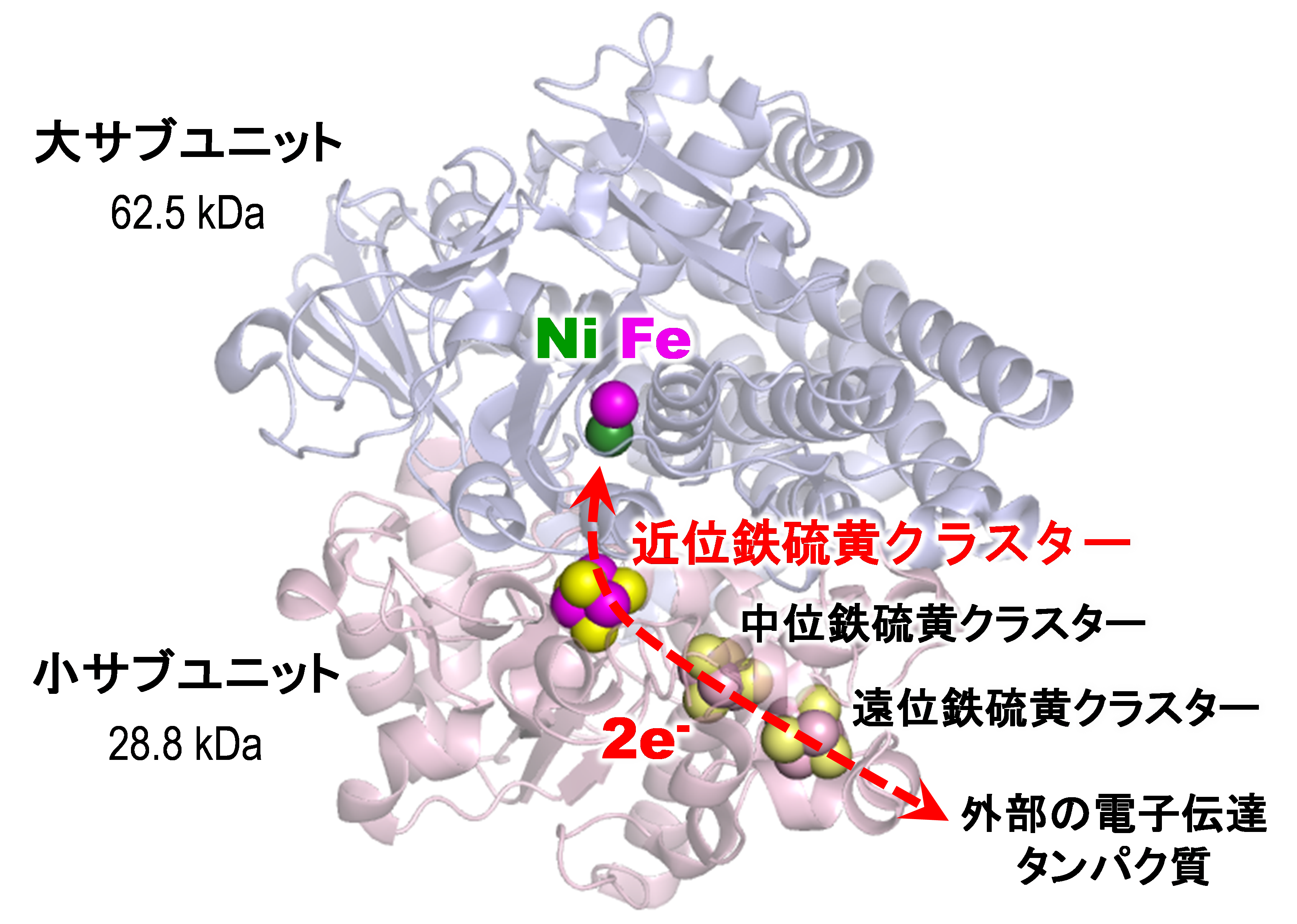
ニッケル-鉄ヒドロゲナーゼは微生物が持つ水素分解・合成酵素である。酵素中の触媒反応を司る中心部分は、ニッケルと鉄原子からなる金属錯体といわれる結合パターンで、ニッケル-鉄活性部位と呼ばれる(図2)。触媒反応が起こる時、水素分子の分解反応では2つの水素イオンと2つの電子が生じ、逆に水素分子の合成反応では2つの水素イオンと2つの電子が消費され、電子については鉄硫黄クラスターという原子の集まりを通って外部のタンパク質分子とやり取りされることは分かっていたが(図1)、触媒反応に関わる水素イオンの輸送経路は不明のままであった。
廣田教授らは、フーリエ変換赤外吸収分光法という分子構造を調べる方法を用いた。これまでにない超高感度で幾つかの中間体の赤外吸収スペクトルを測定し、ニッケル原子に結合しているシステイン残基の硫黄原子に水素イオンが結合したり、逆に解離したりする様子を初めて観測することに成功した。さらに、グルタミン酸残基に水素イオンが付加する現象や水素分子から生じる水素イオンを取り込んだ水分子も観測できた。これにより、分解の時は、水素分子から生じる水素イオンが反応部位(ニッケル-鉄活性部位)からその外へ(水素分子を合成するときは水素イオンが反応部位内へ)輸送されるメカニズムが明らかとなった(図5)。
この成果は、8月13日にドイツの「Angewandte Chemie International Edition(アンゲバンテ・ケミー・インターナショナル・エディション)」のオンライン版で最終版が掲載されました。
1. 背景
水素分子は究極のクリーンエネルギーとして、その利用に向けた基礎および応用研究が急がれてきた。微生物由来であるヒドロゲナーゼという酵素は、水素分子の分解・合成反応(図1)を常温常圧で触媒することから、その分子システムの理解はバイオ電池およびその活性部位を模倣した新規の水素合成触媒や人工燃料電池の開発につながると期待されている。標準的なヒドロゲナーゼである、ニッケル-鉄ヒドロゲナーゼ(図2、3)の高効率な触媒反応の仕組みを理解するためには、酵素のアミノ酸残基がニッケル-鉄活性部位で起こる反応機構と連動し、水素イオンを効率的に活性部位の内外へ輸送する仕組みを解明することが不可欠である。
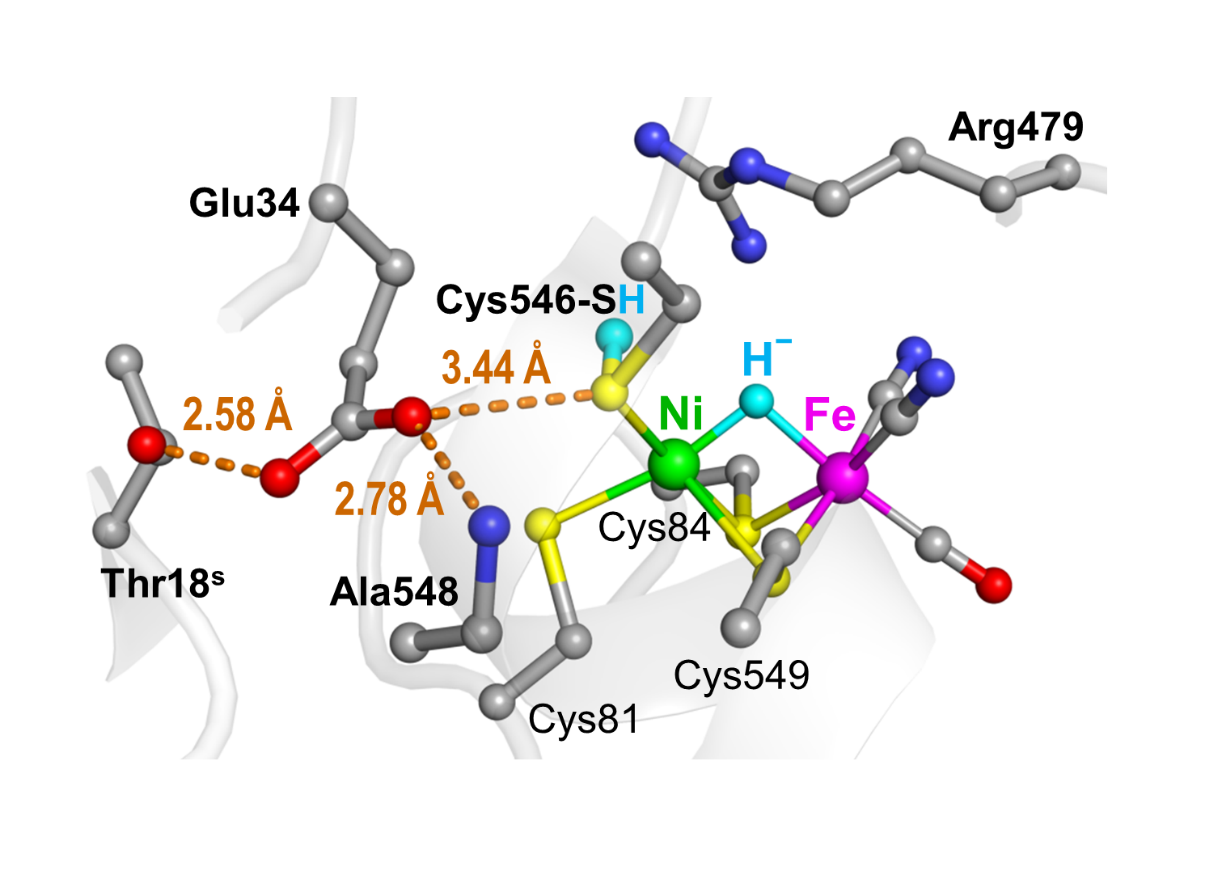
ニッケル-鉄ヒドロゲナーゼの活性部位のニッケル原子には、硫黄(S)原子を含んだ4つの「システイン(Cys)」と呼ばれるアミノ酸残基が結合し、それらのうち2つは鉄原子にも配位し、ニッケルと鉄の橋渡しになる構造を形成している(図3)。これまでの様々な研究により、水素分子の分解・合成が行われるニッケル-鉄活性部位の情報は蓄積されてきた。それにより、ニッケル-鉄活性部位の水素分解により生じる電子が3つの鉄硫黄クラスターを通って外部のタンパク質へ効率的に伝達することが明らかとなっている(図2)。しかし、反応により供給・放出される水素イオンの輸送経路については不明のままであった。
2. 研究手法・成果
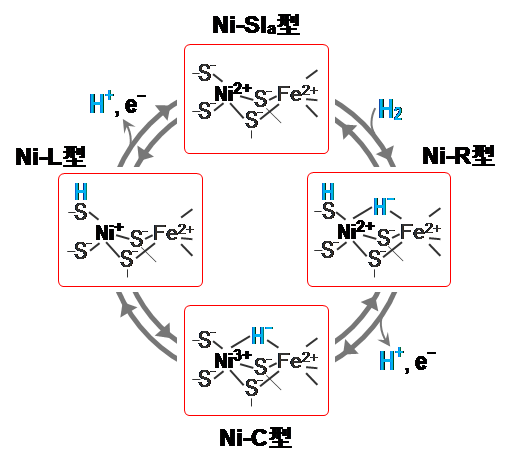
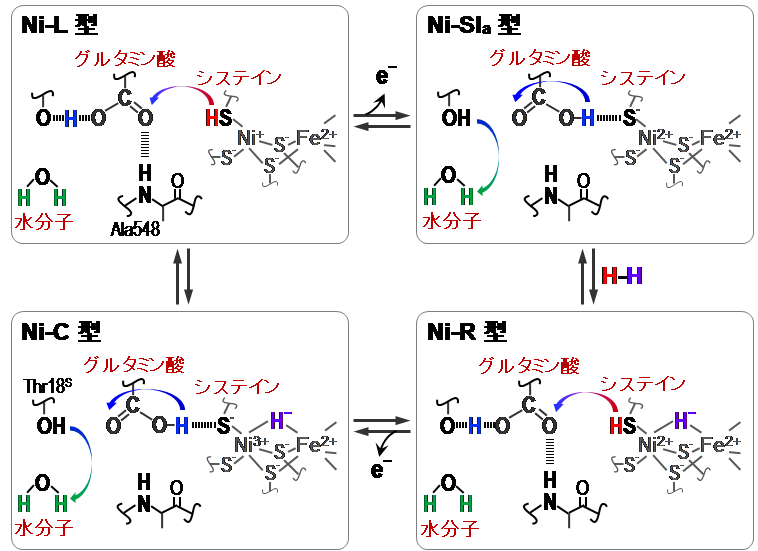
ニッケル-鉄ヒドロゲナーゼでは、ニッケル-鉄活性部位の配位構造の違いにより、Ni-SIa、Ni-R、Ni-C、Ni-L型と呼ばれる4つの状態(中間体)を順に形成して、水素分子を分解する(水素分子を合成する時はNi-SIa、Ni-L、Ni-C、Ni-R型の順に形成)(図4)。
今回、廣田教授、太特任助教らは、このようなニッケル-鉄ヒドロゲナーゼの触媒反応で生じる水素イオンが酵素中を輸送される機構を明らかにした(図5)。
まず、分子の構造が分かる「フーリエ変換赤外吸収分光法(FT-IR)」という手法を用い、レーザー光(波長514.5 ナノメートル)を照射した際のニッケル-鉄活性部位の構造変化を調べた。-135℃でFT-IRスペクトルを精密に測定する装置を組立て、光照射により生成する「Ni-L型」の構造と光照射前の「Ni-C型」のスペクトルをこれまでにない超高感度で比較することが可能になった。その結果、ニッケル原子に結合しているシステイン残基の硫黄原子とこの硫黄原子に結合している水素原子との間の振動に由来するシグナルを2505 cm-1(1センチメートル当たりの波数の単位)の波数に観測することに初めて成功した。
これで、ニッケル原子に結合しているシステイン残基の硫黄原子に「Ni-L型」では水素イオンが付加し、「Ni-C型」では水素イオンが付加していないことが明らかとなった(図5)。同様に、「Ni-SIa型」ではこの硫黄原子に水素イオンが付加していないことが分かった(図5)。
また、超高感度測定により、「Ni-L型」では1700 cm-1、「Ni-C型」では1715 cm-1にこれまで観測できなかったシグナルが観測され、ニッケル-鉄部位の近傍のカルボン酸の水素結合の状態が特定できた(図5)。さらに、酵素反応に関与する特定の水分子1個を観測した。このように巨大分子である酵素で水分子1個を観測できたのは非常に珍しいことである(図5)。
こうしたことから、ニッケル-鉄ヒドロゲナーゼの触媒サイクル中の水素イオンの動きを図5のように特定することができた。
3. 波及効果、今後の予定
水素分子は究極のクリーンエネルギーとしてその利用に向けた基礎および応用研究が急がれてきた。ヒドロゲナーゼは水素分子の分解・合成反応を常温常圧で触媒することから、その分子システムの理解はバイオ電池およびその活性部位を模倣した新規の人工燃料電池や水素合成触媒の開発につながると期待されており、ヒドロゲナーゼの高効率な触媒反応の仕組みを理解するためには、酵素の水素イオンの輸送経路の解明が不可欠である。
本研究により、ニッケル原子に結合しているシステイン残基、その近傍のグルタミン酸残基、酵素内に固定化された水分子の3つが協同して水素イオンを輸送することが明らかとなった。本酵素のニッケル-鉄活性部位における、水素分子の分解・合成の反応の仕組みが詳しく分かってきたことで、今後、人工触媒系の設計に寄与できる情報が増えた(図6)。また、本メカニズムは水素分解・合成を行う化合物合成にも有用な情報となる。
4. 研究プロジェクトについて
本研究は、日本学術振興会、科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域(研究総括:田中啓二)における研究課題「生物酵素による水素エネルギー利用システムの構造基盤解明」(2012年度~2017年度)、および中国国家自然科学基金の支援を受けて行われました。
【論文タイトルと著者】
タイトル:Cysteine SH and glutamate COOH contributions to [NiFe] hydrogenase proton transfer revealed by highly sensitive FT-IR spectroscopy
著者:Hulin Tai, Koji Nishikawa, Yoshiki Higuchi, Zong-wan Mao, and Shun Hirota* (*, 責任著者)
掲載誌:Angewandte Chemie International Edition
【本プレスリリースに関するお問い合わせ先】
奈良先端科学技術大学院大学 先端科学技術研究科 物質創成科学領域 教授 廣田 俊
TEL:0743-72-6110 FAX:0743-72-6119 E-mail:hirota@ms.naist.jp
<報道担当>
奈良先端科学技術大学院大学 企画総務課 広報渉外係 近藤・福本
TEL:0743-72-5026 FAX:0743-72-5011 E-mail:s-kikaku@ad.naist.jp
【用語解説】
- フーリエ変換赤外吸収分光法(FT-IR):
赤外吸収分光法は、分子の振動による赤外線吸収を測定することで、分子構造の情報を得る振動分光法の1つである。干渉計を用いたフーリエ変換赤外吸収分光法は波数精度が極めて高く、近年広く使用されている。観測される振動数は、分子内の結合の強さに鋭敏であり、反応種の状態を特定するときにも用いられる。ニッケル-鉄ヒドロゲナーゼでは、鉄原子に結合した1つの一酸化炭素(CO)と2つのシアン化物イオン(CN-)に由来するバンドがそれぞれ、1880~1970 cm-1に1つ、2040~2110 cm-1に2つ観測され、これらのバンドの振動数より、ヒドロゲナーゼの状態を特定することができる。 - システイン:
アミノ酸の一種で、側鎖に硫黄原子を持つ。ニッケル―鉄ヒドロゲナーゼでは、2つのシステイン残基がニッケルと鉄を橋渡しした構造を形成している。さらに、別の2つのシステイン残基が架橋せずにニッケル原子に結合している。水素分子から生成する水素イオンは、架橋していない1つのシステイン残基の硫黄原子に結合すると考えられている。遊離の状態では、側鎖の硫黄原子のプロトン化状態/脱プロトン化状態のpKa(酸全体の半分が解離した時のpH)は8.4であるが、タンパク質内ではシステイン周りのアミノ酸残基による水素結合や電荷、硫黄原子の金属への結合などにより値が変化する。 - グルタミン酸:
アミノ酸の一種で、側鎖にカルボン酸を有する。カルボン酸のプロトン化/脱プロトン化により、水素イオン(プロトン、H+)を輸送することができる。遊離の状態では、側鎖カルボン酸のプロトン化状態/脱プロトン化状態のpKaは4.1であるが、タンパク質内ではカルボン酸周りの環境により値が変化する。
【本研究内容についてコメント出来る方】
京都大学大学院 農学研究科 応用生命化学専攻 教授 加納健司
TEL:075-753-6392 FAX:075-753-6454 Email:kano.kenji.5z@kyoto-u.ac.jp