2021/03/23
細胞間の情報伝達に関わる細胞外微粒子の新たな形成機構を解明
~細胞膜の突起の切断により生成、細胞の移動を速める~
【概要】
奈良先端科学技術大学院大学(学長:横矢直和)先端科学技術研究科バイオサイエンス領域の末次志郎教授の研究グループは、老化やがんなどの生体情報の伝達を担うことで注目されている「細胞外小胞」という脂質膜の微粒子について、細胞表面で突起した生体膜がちぎれて生み出されるという新たな機構を明らかにしました。細胞外小胞は、老化やがんなどのさまざまな疾患に伴い、その量が増減することから、バイオマーカーなどの用途が期待されています。しかし、この細胞外小胞が形成される仕組みについては、細胞内に蓄積されたあとに、外部に放出される機構など、わずかなパターンしか知られておらず、十分に説明することができません。また、この不明瞭さの原因のひとつには、頂端側の細胞表面(細胞の上部)は高精度の観察が困難であり、細胞全体を俯瞰して細胞外小胞の放出を観察することが困難であったこということがあります。末次教授らは、細胞の脂質膜(生体膜)の微細な形づくりを担うBARドメインと呼ばれるタンパク質モジュール(集合体)の研究を行ってきました。BARドメインタンパク質は、生体膜上で集まり、ブロックのように固有の形態を作ることで、生体膜の形を制御します。すでに末次教授らは、細胞突起については、BARドメインの一種であるI-BARドメインによる細胞膜の変形によっても生じることを明らかにしています。細胞突起はこれまでに、細胞の移動のための構造であると考えられていましたが、細胞間の情報伝達を担うとは考えられていませんでした。本研究では、細胞膜の変形によって生じた細胞突起が、毛細血管の圧力相当の生体内で通常に観察できる程度の外力により切断されて、細胞外小胞となることを見出しました。高解像度の蛍光顕微鏡である「格子光シート顕微鏡」などを用いて細胞突起がちぎれる瞬間をとらえ、さらに、細胞の頂端側を含む細胞の全表面からの小胞放出の頻度と外力の指標の相関を測定することで証明しました。また、見出した細胞外小胞は、これを受け取った細胞の移動能力を増強させることや、これまでに知られていた形成機構による細胞外小胞とは含まれるタンパク質の種類などが異なることがわかりました。細胞外小胞の形成機構の解明により、老化やがんとの関わりや、類似の機構とみられるウイルス小胞の放出(産生)機構の解明に向けた基礎知識を提供することができたと考えられます。この研究成果は、国際科学誌「Developmental Cell」に2021年3月23日(日本時間)に掲載されます。
【解説】
<研究の背景と経緯>
細胞外小胞は、老化やがんなどのさまざまな疾患に関連する現象に付随して量が増減する細胞外微粒子として注目を集めてきました。細胞外小胞は、脂質膜小胞であり、血液中にも放出されることから、さまざまな疾患の診断のバイオマーカーとして用いられようとしています。また、がん細胞の遠隔転移などにも積極的な役割を果たしていることが知られています。しかし、細胞外小胞の形成機構は、細胞のエンドソームと呼ばれる細胞小器官の内腔(内側の空間)に蓄積された細胞外小胞が放出される機構などが知られていましたが、これは一部で機構あり、細胞外小胞の形成機構の全容は明らかになっていませんでした。また、形成機構が不明であることなどにより、どのような種類の細胞外小胞があるか、明らかでありませんでした。一方で、細胞表面から出芽する形で増殖するウイルスなどは、細胞表面から切断されてウイルス粒子となることが知られていますが、そのような現象が細胞に内在されているかどうかは、不明でした。この不明瞭さの一端は、細胞外小胞の形成過程の顕微鏡観察が不十分であったことにもよっています。顕微鏡は通常焦点面の解像度は高いですが、深さ方向の解像度は低く、観察レンズから遠く離れた内側の細胞表面、すなわち、細胞の頂端側は、高精度の観察が困難であったことに起因し、細胞全体を俯瞰して細胞外小胞の放出を定量的に捉えることは困難でした。末次教授らは、細胞の脂質膜(生体膜)の微細な形態形成を担うBARドメインと呼ばれるタンパク質モジュールの研究を行ってきました。BARドメインは、タンパク質が生体膜上で集まり、ブロックのように形態を作ることで、生体膜の形態を制御するタンパク質ドメインです。細胞突起は、BARドメインの一種であるI-BARドメインによる細胞膜の変形によっても生じることが、末次教授らにより明らかにされていました。細胞突起はこれまでに、細胞の移動のための構造であると考えられていましたが、細胞間の情報伝達を担うとは考えられていませんでした。また、BARドメインの他の種類であるN-BARドメインやF-BARドメインは、細胞内部への小胞形成を通じた物質輸送などに関与していることが知られており、このときにN-BARドメインが、脂質膜小胞の形成に関わっていますが、I-BARドメインのそのような機能は知られていませんでした
<研究の内容>
本研究では、奈良先端大の末次教授らのグループにおいて、ドメインを持つタンパク質の性質を調べ、試験管内の実験において、脂質膜の小胞形成を誘導することを見出しました。次にMIMの細胞機能を調べ、まず細胞のもつMIMタンパク質量が、細胞突起の形成と、細胞外小胞の量と関連していること見出しました。次に、奈良先端大の細川教授らと共同で、細胞突起の切断に要する力を、フェムト秒パルスレーザーを用いた衝撃力により調べ、生体内と同程度の力が切断を誘導することがわかりました。次に、理化学研究所 清末チームリーダーらと共同で、格子光シート顕微鏡により、切断の様子を可視化することに成功しました。さらに、細胞の頂端側を含む細胞の全表面からの小胞放出の頻度と外力の指標の相関を測定しました。これらのデータから、細胞突起は生体内で普遍的に見られる外力により切断され、細胞外小胞に転換されることを示しました。
さらに、MIMによる細胞突起に依存した細胞外小胞に含まれるタンパク質や脂質を理化学研究所 有田チームリーダーや東京大学 青木教授らと調べ、今回見出した細胞外小胞が、リゾリン脂質と呼ばれる脂質を含むことで、細胞突起の切断を容易にしていること、また、これらの細胞外小胞に濃縮しているタンパク質を同定しました。
このあと、見出した細胞外小胞を、細胞に添加すると、細胞外小胞を受け取った細胞の移動能力を増強すること、またこの増強は、細胞外小胞に濃縮しているタンパク質に依存することもわかりました。また、これまでに知られていた機構によって形成される細胞外小胞とは含まれるタンパク質などが異なっていました。以上の結果は、新しく見出した細胞突起の切断による細胞外小胞は、特定のタンパク質の輸送に関わり、またその輸送によって、生物機能を発揮することが示されました。
<今後の展開>
細胞外小胞の形成機構の解明により、細胞外小胞の関与する老化やがん形成、あるいは類似の機構を使うことが示唆されるウイルス小胞の放出(産生)機構の解明に向けた基礎知識を提供することができたと考えられます。また、DDS(薬物輸送システム)キャリアなどとして細胞外小胞を利用するためには、細胞外小胞の形成機構の解明が不可欠と考えられますが、その基礎知識の提供できたと考えられます。
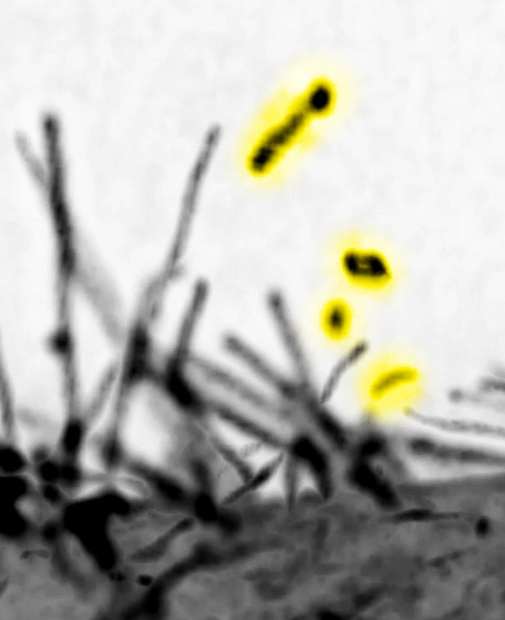
図1.格子光シート顕微鏡による細胞突起と細胞突起に由来する細胞外微粒子(黄色でハイライト)
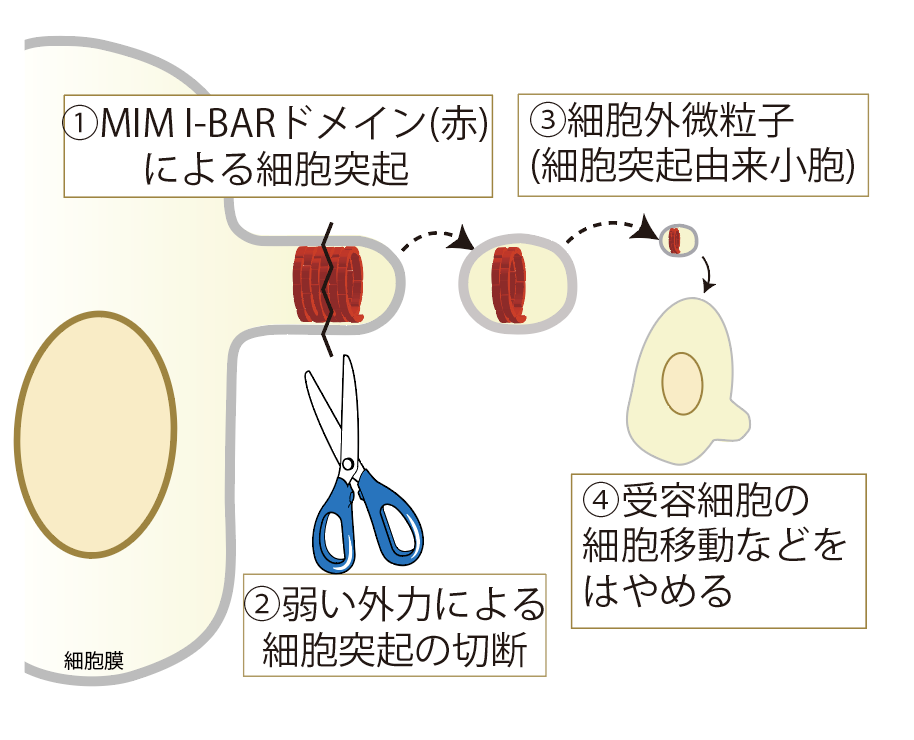
図2 細胞突起の切断による細胞外微粒子形成と細胞運動の亢進
【用語解説】
- (*1)細胞突起:(フィロポディア)糸状仮足ともよばれ、運動性が高く、細長い細胞表面の突起構造。
- (*2)脂質膜:生体膜は脂質膜から構成され、脂質膜を構成する脂質は、水になじむ親水性部分と水になじまない疎水性の部分からなる両親媒性脂質です。水溶液中では水になじまない疎水性の部分が水中で向き合い、水になじむ親水性の部分が水溶液に面しています。生体膜を構成する両親媒性脂質として代表的なものに、フォスファチジルセリン、フォスファチジルコリン、フォスファチジルエタノールアミンなどがあります。
- (*3)Bin-Amphiphysin-Rvs (BAR):ドメインBARドメインはカーブ構造をしており、脂質膜に結合することで、タンパク質の形を鋳型として、小胞を含む脂質膜の形態を形成します。このように生体膜の形を制御するタンパク質としては、ほとんど唯一知られているタンパク質です。BARドメインは、BAR、F-BAR、I-BARの3種に大別されます。この中で、I-BARドメインは主に細胞突起形成に関与すること、F-BARドメインおよびBARドメインは、主にエンドサイトーシスに関与することがわかっていました。
- (*4) 格子光シート顕微鏡:薄い光シートを用いて、細胞などの観察対象を走査して断面画像を連続的に取得することで、立体的な画像を高速で取得する顕微鏡。従来の顕微鏡と比較すると、光シートを用いることで、焦点深度方向の解像度が飛躍的に向上し、細胞全体を俯瞰しつつ高精度で観察することが可能となりました。格子光シート顕微鏡は、米国ハワード・ヒューズ医学研究所のBetzig研究室ににおいて開発され(Science 346, 6208, 2014)、その技術情報に基づいて、理化学研究所とJST 戦略的創造研究推進事業 CRESTにより、清末研究室で構築・運用されているものを用いました。
【論文情報】
<論文タイトル>Filopodium-derived vesicles produced by MIM enhance the migration of recipient cells
(MIMタンパク質による細胞突起(フィロポディア)由来小胞は、受容細胞の細胞運動を亢進する)
doi:10.1016/j.devcel.2021.02.029
【本プレスリリースに関するお問い合わせ先】
<機関窓口>
奈良先端科学技術大学院大学 企画総務課 渉外企画係
TEL:0743-72-5026 E-mail:s-kikaku[at]ad.naist.jp
<研究に関する事>
奈良先端科学技術大学院大学 先端科学技術研究科
バイオサイエンス領域 分子医学細胞生物学研究室
教授 末次志郎
TEL : 0743-72-5430
E-mail : suetsugu[at]bs.naist.jp
※上記の[at]は@に置き換えてください。






