~広報誌「せんたん」から~
[2015年1月号]
物質創成科学研究科 超分子集合体科学研究室 廣田俊教授、松尾貴史准教授

多様な構造が生命現象のカギになる
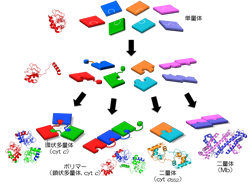
一口にタンパク質と言ってもアミノ酸が多数連なった高分子だから、構造や機能にさまざまな種類がある。さらに、それらのタンパク質がパズルのピースのようにいくつか組み合わさって「超分子」になり、生命の営みに欠かせない機能を発揮することも多い。たとえば、体内で酸素を運ぶ赤血球中のヘモグロビ ンというタンパク質は、酸素と結合する鉄を含む4つのパーツ(α鎖2 つ、β鎖2 つ)で構成され、酸素を体内で効率的に運搬するように精密に設計されている。
このような超分子を作る新たな仕組みを開 発するとともに、新しい組み合わせを考えてこれまでにない機能を発揮させる。ミクロなタンパク質分子の生体パズルに取り組んでいるのが、超分子集合体科学研究室である。
廣田教授によると、超分子を構成するタンパク質が集まる仕組みを詳細に解明できれば、アルツハイマー病などタンパク質が会合して変性することが原因とみられる複数の病気の謎が明らかになる。そのうえ、生体になじむ創薬につながる新たな機能性材料の開発も期待できる。具体的には「タンパク質が会合体や多量体といった超分子構造を取って機能を喪失してしまうことがあり、その仕組み を調べています。また、会合することにより新たな機能を発揮することがあり、環状や鎖状、ジャングルジムの形のような分子構造の材料などさまざまなパターンを自動的に組織化する機能性材料の作製も進めています」と説明する。
半世紀ぶりにつなぎ目の仕組み解明
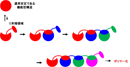
廣田教授らの主要な研究対象が、生物の呼 吸に欠かせないタンパク質である「シトクロムc」。その分子の立体構造が変化し、いくつも鎖状につながった多量体ができてしまえば 機能を失うという現象は、発見から半世紀にわたり謎だったが、その仕組みを世界で初めて明らかにした。
研究では、シトクロムcの多量体を作製し て結晶化することに成功。大型放射光施設SPring-8の放射光X線を使って構造解析したところ、分子間のつなぎ目は、分子が互いに 同じ構造の領域を交換して入れ込ませる「ドメイン・スワッピング」という仕組みでつく られていることをつきとめ、このパターンが 複数の分子で連続して起きていることがわ かった。このような現象は、若年性認知症、肝硬変、肺気腫などを起こすタンパク質でも見られ、これらの病気の原因解明や、この反応を阻害し、予防・治療する創薬につながる研究と期待される。
超分子の研究は廣田教授が本学に赴任した 2007年から始めた。「病気の原因になるタン パク質の振る舞いの解明のほか、複数のタン パク質を組み合わせた人工タンパク質超分子 の創製、病巣まで薬物を運ぶタンパク質 (DDS)の開発なども手掛けています。タンパ ク質を自由自在に組み合わせて役に立つ新し い材料をつくりたい。まずは、その技術の開発です」と抱負を述べる。
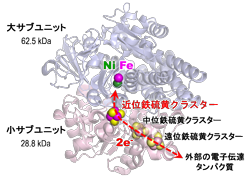
研究成果は幅広く、最近では機能性材料の分野で水素分子の分解・合成反応を触媒する酵素(ニッケル-鉄ヒドロゲナーゼ)の反応を制御する部位を突き止め、そのメカニズムを初めて解明した。新たなタイプの燃料電池の開発にもつながる研究だ。
「若手は誰もやっていないテーマにチャレン ジしてほしい。論文から自分らしさが染み出てくるような独自性のある研究ができればいいとは思います」と廣田教授。趣味は卓球などスポーツ全般や旅行だが、最近はほとんど時間がないそうだ。
タンパク質をフラスコに
松尾准教授は、有機合成と分子生物学という異なる分野での手法の利点をうまく組み合わせてタンパク質に新たな機能を持たせる研究を続けている。
具体的には、タンパク質の構造空間をフラスコのように使い、そこで反応する生体触媒をつくった。この触媒は、ノーベル化学賞の対象にもなった有機化学の中でもっとも大切な合成反応(オレフィンメタセシス反応)をやってのける。それは、オレフィンという炭素と炭素の二重結合を持つ有機化合物をくっつけるさい、二重結合を組み替えて、新たな炭素と炭素の結合をつくるもの。通常の触媒である金属を含む錯体と呼ばれる化合物をタンパク質と結合して使う。生体触媒は国際競争の激しい分野で、松尾准教授は「タンパク質も有機金属も両方研究の経験があることから、思いつきました。タンパク質は非常に面白い分子で、うまく分子デザインすれば、フラスコのような反応の場として使えそうです」と期待する。生体触媒については、「タンパク質のいい所を取り入れながらも独自の分子を設計して加え、自然にはない機能を発揮させるようにしたい」という。
また、タンパク質の中には、光の照射や小分子の結合など条件によって構造を柔軟に大胆に変化できるものがあり、これを「オン」「オフ」のスイッチに使う研究も手掛けている。「タ ンパク質ならではの特徴を使って、面白い化学反応システムや機能材料ができればいい。もともと、生物がつくり上げた高分子なので、 生命現象にとっては非常にいい形になっているはずです」。
松尾准教授は根っからの有機化学好きで、生命現象にも興味があることから、タンパク質の研究に進んだ。「最初から何かの役に立つものをつくるというよりは、化学反応の推移を追いかけることの方に興味があります。面白い現象が見つかっても、なぜそうなるのか、反応機構の解明を優先するようにしています。そうすれば、研究過程で幾度となく壁にぶち打ち当たることがあってもテーマが広がっていくのが楽しい」という。実家は京都のユズ生産農家で、秋の収穫時には手伝いに出かけることもある。「生物に対する興味もそこから生じたのかもしれません」
結果が出なくてもメゲない

研究室の若手も幅広いテーマの一翼を担って張り切っている。
博士後期課程3年の林有吾さんは、シトクロムc がドメイン・スワッピングにより多量 化するメカニズムを調べている。「最近、シトクロムc が大腸菌の中でもドメイン・スワッピングしている現象がわかってきました。試験管の中に比べて、大腸菌はいろいろなタン パク質があり複雑な環境なので面白いと思います」と意欲を見せる。「タンパク質は、結合 したアミノ酸の鎖が折りたたまれて立体構造になるさい、少し間違った形になることもある。そうなれば、くっついてしまい、アミロイド線維になって病気を起こすのではない か、と思います」という。研究は試行錯誤の連続だが「結果が出なくてもメゲないという 精神で頑張ってきた 」と振り返る。本学のグ ローバル化や博士課程学生に対する支援が手厚いことなどを気に入っていて、「大学でも民間でも研究者になりたい」という思いは強い。
博士前期課程2年の小林紀(ひさし)さん は、細胞内の小器官、ミトコンドリアの内部にあるシトクロムc が、その膜との相互作用 により構造や機能が変化するかどうかを調べ ている。「分子の構造や振る舞いがわかる核磁 気共鳴(NMR)分光法という測定法で解析していますが、シトクロムc が活性を失わない形でさまざまな弱い相互作用をしていることがわかってきました。タンパク質が巨大な分子で、その複雑な相互作用と機能の関係に好奇 心を抱き、それをバネにして進んできただけに、新たな知見が得られてうれしい」と喜ぶ。「本学は学生に対して教員の人数が多く、細部に至るまで指導が行き届いているところが、ありがたく、研究を続ける意欲が高まります」。
博士前期課程1 年の石田昌也さんのテーマ は、細胞が自ら壊れていく細胞死(アポトーシス)で、それを促す2種類の酵素(カスパーゼ3とその前駆体)と、酵素活性を上昇させる有機小分子との相互作用を調べている。「がん細胞内では、本来、アポトーシスが阻害され ていて、有機小分子を入れると進行するという報告があります。それがどれだけ、どのような形で効いているのかを調べています。新たながん治療法に結びつけていきたい」と話す。酵素の前駆体の方を調べていて、現在は 材料の準備段階だが「有機小分子 が、どのような仕組みで作用しているかわかれば、有効な薬剤の開発にもつながります。とにかく納得するまで研究を続けたい」と夢は膨らむばかりだ。



